Introdução
Artrose reumatóide (AR) é uma doença auto-imune, de natureza poligenética, caracterizada por poliartrite com manifestações sistêmicas e morbidade aumentada e grave.1,2 A AR afeta 0,5%-1% da população, causando uma diminuição da qualidade de vida, incapacidade física significativa e um custo econômico substancial.3-6 A expressão clínica da doença é variada, variando de formas leves de autolimitação a uma evolução muito agressiva e rápida que culmina com a destruição da articulação afetada e a incapacidade resultante.7
Estudos genéticos confirmaram a existência de um substrato genético, parcialmente relacionado a certos genes que codificam proteínas envolvidas nas respostas das células T.1 Estes achados reforçam a importância do papel atribuído às células T no início e perpetuação da resposta imune anormal nesta doença.8
A patogênese da AR é complexa e envolve diferentes populações celulares relacionadas à resposta imune inata e adaptativa. Células residentes no sinovium, como os sinoviócitos fibroblásticos B ou macrófagos da íntima, e células inflamatórias do sangue como linfócitos T, linfócitos B e monócitos9 estão envolvidos na patogênese. Todos eles contribuem para a transformação agressiva do fenótipo do sinoviócito B e o desenvolvimento de um intenso infiltrado inflamatório com o resultado final da cartilagem e destruição do osso subcondral10,11 (Fig. 1).
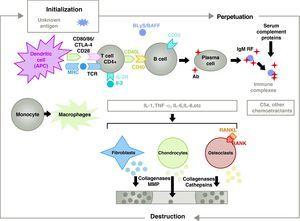
Patofisiologia da artrite reumatóide. Organização patofisiológica geral da artrite reumatóide. AC, anticorpos; BAFF, fator ativador de células B; BLyS, estimulante linfocitário B; CD, cluster de diferenciação; CPA, célula apresentadora de antígeno; CPH, MHC; CTLA4, antígeno associado ao antígeno 4 T, complemento da fração C5a citotóxica 5a, FR, fator reumatóide; Ig, imunoglobulina; IL, interleucina; MMP, metaloproteinases de matriz; RANK, ativador receptor do fator nuclear B kappa; RANKL, ativador receptor ligante para o fator nuclear B kappa; RCT, receptor de células T; TNF, fator de necrose tumoral.
O tratamento atual da AR é baseado na administração de drogas anti-reumáticas modificadoras da doença (DMARDs) usadas isoladamente ou em combinação.12 Esses medicamentos retardam a destruição articular, ou seja, são capazes de modificar o curso natural da doença.4,13 Entretanto, a porcentagem de pacientes com resposta clínica satisfatória é baixa e freqüentemente requer a adição de um medicamento biológico em uma alta porcentagem de pacientes.9,13-15
Nos últimos anos foram identificadas novas moléculas e alvos terapêuticos cujo bloqueio poderia reduzir ou eliminar a resposta inflamatória crônica. Uma dessas novas moléculas é a abatacept. O abatacept é uma construção proteica totalmente humanizada, consistindo do domínio extracelular do linfócito T linfocitário humano associado ao antígeno 4 (CTL4) e um fragmento geneticamente modificado da região Fc da imunoglobulina humana G1 (IgG1), que inibe a costimulação das células T atuando no verdadeiro núcleo da resposta imunológica e, portanto, no início da doença.
Ativação celular T
Ativação imune efetiva das células T requer a participação de dois grupos de receptores de membrana em células com antígeno (APC)14 (Fig. 1 e 2). O primeiro é o veículo utilizado pelos APCs para fornecer o antígeno específico previamente processado para a célula T. Apesar do enorme esforço dedicado a esta pesquisa, ainda não conseguimos identificar os antígenos artritogênicos que ativam a AR.8 Apresentação pelos APCs de um antígeno contra o qual uma resposta imunológica específica é montada é organizada através de um complexo trimolecular composto por: moléculas do complexo de histocompatibilidade maior (MHC) presentes no APC, o antígeno contra o qual a resposta imunológica se desenvolve e um receptor de membrana na célula T (TCR) específico para aquele antígeno15 (caminho de sinal ou sinalização da resposta imunológica 1).
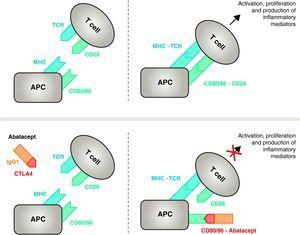
Mecanismo de ação do abatacept. O fragmento abatacept que compreende o domínio extracelular do CTLA4 liga-se aos receptores CD80/CD86, impedindo ou deslocando a sua interacção com o receptor CD28. Desta forma, ele bloqueia seletivamente a ligação específica do receptor CD80/CD86 ao CD28, que é, patofisiologicamente, um bloco do segundo sinal para ativação imune e, portanto, ativação do CPA das células T, célula apresentadora de antígenos; MHC, complexo de histocompatibilidade maior; TCR, receptor de células T.
Para inibir a ativação total, as células T requerem um segundo conjunto de receptores de comunicação intercelular entre os APCs e as células T que ocorre através das vias costimulatórias e constitui os chamados 2 sinais de resposta imune.14 Embora existam várias vias costimulatórias, uma é essencial, a ligação dos receptores CD80 (B7-1)/CD86 (B7-2) na membrana do CPA com o receptor CD28 em células T.10,16 A ativação simultânea de ambas desencadeia intensa sinalização intracelular em células T, essencial para a ativação plena, proliferação, sobrevivência e produção de citocinas 8. Às 24-48h da ativação dos linfócitos T, a mesma sinalização intracelular inicia um mecanismo regulador que visa desativar a própria resposta. Isto induz a expressão do CTLA411 na membrana celular linfocitária com a tarefa de competir com o CD28 devido à sua maior afinidade de ligação ao CD80/CD86.17,18
A ativação de ambos os subconjuntos de células T, CD4+ e CD8+, depende do receptor costimulador CD28. As células T CD4+ são células T de ajuda. Elas reconhecem os peptídeos apresentados pelas moléculas MHC classe II presentes no APC. Estes antígenos se originam da via exógena que processa patógenos como as bactérias. Muitas doenças auto-imunes estão associadas a uma resposta patológica das células T CD4+. Por sua vez, as células CD8+ T são linfócitos citotóxicos (CTL). As células CD8+ T reconhecem antígenos, principalmente virais e tumorais apresentados pelas moléculas MHC da classe I. Quando ativadas, as células CD8+ medeiam a destruição da célula alvo através da produção de perforina, granzimas e interferon (IFN)-g. Ambos os subtipos de células T são ativados por costimulação com CD2815, embora a ativação das células T CD8+ seja menos dependente desta via de costimulação. De fato, enquanto todas as células CD4+ expressam CD28 em sua membrana, isto ocorre apenas em cerca de 50% de CD8+.19 Além disso, as células CD4+ demonstraram uma maior resposta à ligação CD2820. Além disso, o promotor CD28 não é um requisito absoluto para ativação de CTL.21 Tudo isso proporcionaria um duplo benefício terapêutico na prática clínica. Por um lado, o abatacept atua preferencialmente sobre a célula alvo na patogênese da doença. Além disso, a reduzida ação sobre a atividade dos linfócitos CD8+ garantiria um melhor perfil de segurança em termos de complicações virais e tumorais.
Ativação das células T CD4+ é o ponto de partida para uma cascata pró-inflamatória com produção de grandes quantidades de citocinas e proliferação celular que, se perpetuada e mantida, como na AR, leva a uma inflamação crônica muito ativa, capaz de destruir os tecidos em que é desencadeada, principalmente as articulações no caso da AR8 (Fig. 1). O sinovium começa a proliferar devido à infiltração de células do sangue, incluindo os próprios linfócitos T e seus subtipos, assim como os linfócitos B. Os monócitos diferenciam-se em macrófagos e osteoclastos e também ativam condrócitos articulares. Neste ambiente existem grandes quantidades de citocinas pró-inflamatórias como a interleucina (IL)-1, IL-6 e o fator de necrose tumoral (TNF) e muitos outros. As células B também produzem auto-anticorpos, como o fator reumatóide ou anticorpos peptídeos anti-citralizantes. Todos estes levam à destruição não só da membrana sinovial, mas também do osso e cartilagem subjacentes.22
Biotecnologia no Tratamento da Artrite Reumatóide
Por causa das pesquisas acima mencionadas, a fabricação biotecnológica de várias moléculas com o objetivo de bloquear alvos específicos foi desenvolvida e comercializada. A primeira geração foi caracterizada pelo aparecimento de drogas neutralizantes de TNF: etanercept, infliximab e adalimumab e anakinra, que inibem a ação da IL-1. Posteriormente, novas moléculas surgiram, como abatacept, para modular a costimulação da resposta imune, certolizumab e golimumab para bloquear o TNF, rituximab contra o receptor CD20 de linfócitos B, e tocilizumab que bloqueia a IL-6.7,23-26
Apesar do enorme salto em termos de eficácia terapêutica devido à introdução desses medicamentos, uma porcentagem substancial de pacientes, estimada entre 25% e 40%, não responde aos medicamentos ou biológicos atualmente comercializados ou são afetados pela ocorrência de eventos adversos.27-32 A necessidade de melhorar esta situação continua a ser um estímulo na busca e desenvolvimento de novas moléculas destinadas a regular diferentes alvos terapêuticos que possam melhorar a eficácia terapêutica, como é o caso do abatacept, que modula seletivamente a ativação das células T.33
Abatacept é uma construção proteica que é produzida através da tecnologia do DNA recombinante nas células do ovário do hamster.34,35 Esta molécula foi concebida para interferir na regulação das vias costimulatórias nas células T, que desempenham um papel importante na patogênese de várias doenças auto-imunes, infecções, rejeição de órgãos transplantados e imunidade tumoral.36
Abatacept é usado em combinação com o metotrexato em pacientes com AR que tiveram uma resposta inadequada ou intolerância a outros DMARD, incluindo o metotrexato (MTX) ou um inibidor do TNF-alfa. Na artrite idiopática juvenil poliarticular é indicado em pacientes com 6 anos ou mais que tiveram uma resposta inadequada a outros DMARD, incluindo pelo menos um medicamento neutralizante de TNF.35
Mecanismo de Ação do Abatacept
Abatacept é um modulador seletivo do sinal estimulante do CD80/86-CD28, e como discutido anteriormente é essencial para ativação de células T. O Abatacept inibe a ativação das células T, bloqueando seletivamente a ligação específica do receptor CD80/CD86 no APC para CD28 na célula T (Fig. 2).22,37 A estratégia farmacológica procura inibir a resposta imune/inflamatória acelerada, característica da doença, e restaurar a homeostase normal no sistema imunológico. De fato, a competição entre CD28 endógeno e CTLA4 para ligação a CD80/86 é o mecanismo fisiológico usado para regular e, quando apropriado, concluir uma resposta imune normal. Abatacept, ao bloquear a ligação do CD80/86 ao CD28 inibe a transmissão de um segundo sinal da resposta imunológica, que indiretamente produz um sinal negativo na ativação da célula T. Além disso, o abatacept provavelmente tem um efeito maior na prevenção da formação de um sinal costimulatório nas células T, inativando aquelas já ativas, que não estão ligadas à célula T CTLA4
Fármaco de apoio ao uso
1. Porque é que o abatacept está incluído no grupo dos medicamentos imunomoduladores? Basicamente, porque produz depleção celular, especialmente de células T devido à ação farmacológica exercida por não bloquear seletivamente uma determinada citocina, evitando a supressão radical das vias essenciais para o bom funcionamento da resposta imunológica.8
2. Como evita a ligação da região Fc da molécula ao seu receptor? A região Fc do abatacept é geneticamente modificada, de modo que não se liga aos receptores CD16 e CD32, e o faz de forma muito fraca ao receptor CD64. Esse desenho contorna as respostas celulares mediadas pelo receptor Fc, como a citotoxicidade celular dependente do corpo (ADCC) e a citotoxicidade dependente do complemento (CDC).18 Ambos estão associados à lise celular, com efeitos adversos potenciais que podem ser observados em tratamentos prolongados38. Portanto, o fragmento modificado de IgG1 parece estar ativo, prevenindo assim eventos adversos resultantes do ADCC.39
3. Efeito antiinflamatório do abatacept. O abatacept reduz significativamente muitos dos mediadores inflamatórios em pacientes com AR, restaurando-os ao normal, fato demonstrado em vários ensaios clínicos utilizados na pesquisa do medicamento.
Num estudo fase II-b, 1 ano, placebo-controlado em pacientes com AR e resposta inadequada ao MTX, foram coletadas amostras e medidos os níveis séricos dos marcadores selecionados nos dias anteriores à infusão, a fim de estudar o efeito do abatacept sobre os mediadores e as citocinas pró-inflamatórias. Um grupo de pacientes recebeu MTX e abatacept 10mg/kg, de acordo com a programação regular. O grupo controle, entretanto, foi tratado com MTX e placebo. Um ano após o tratamento, os marcadores no grupo abatacept de 10mg/kg tinham normalizado, enquanto permaneciam elevados no grupo placebo (TNF: 7,4 vs 10,3pg/ml; FR: 159 vs 225U/l, sIL-2R: vs 1228,3. 1697,1pg/ml IL-6: 7,3 vs 19,9pg/ml).40
4. Imunogenicidade. Segundo dados sobre o medicamento, apenas 187 de 3877 (4,8%) pacientes com AR tratados por até 8 anos com abatacept desenvolveram anticorpos para o medicamento durante o tratamento.41 Os anticorpos para abatacept foram avaliados em pacientes após a interrupção do medicamento (>42 dias após a última dose), e em 103 de 1888 (5,5%) foram seropositivos. Em contraste, em outro estudo de 2000 pacientes com abatacept, foram medidos anticorpos e concluiu-se que o abatacept tem baixa imunogenicidade.42,43
5. Abatacept e tuberculose. O TNF participa da resposta inflamatória e imunopatologia da tuberculose (TB). Estudos in vitro mostram que o TNF aumenta a atividade fagocitária e macrófago micobactericida, enquanto que in vivo estavam envolvidos na formação inicial e posterior manutenção dos granulomas, algo que controla o crescimento das micobactérias e limita a sua propagação. Em um modelo crônico de reativação da TB latente em camundongos, estudamos a evolução da infecção em camundongos tratados com abatacept em comparação a outro grupo tratado com um anti-TNF murino monoclonal.42 4 meses após a infecção de camundongos C57BL/6 com Mycobacterium tuberculosis e, uma vez confirmada a infecção por TB latente, os camundongos foram tratados por 16 semanas com uma das duas intervenções experimentais. Após esse tempo, todos os camundongos tratados com anti-TNF morreram de tuberculose disseminada com uma sobrevida média de 44 dias. Pelo contrário, nenhum dos camundongos tratados com abatacept morreu.
Embora a concentração sérica de IFN-g não tenha mudado no grupo abatacept, ela foi elevada em camundongos com anti-TNF. Este aumento foi atribuído ao aumento da infiltração de CD4+ e CD8+ causada pela dispersão generalizada das colônias bacterianas.
Então, enquanto ratos tratados com terapia anti-TNF apresentaram 100% de mortalidade, o abatacept não alterou a capacidade dos ratos de organizar uma resposta inflamatória capaz de controlar a propagação da tuberculose. Entretanto, ainda não há dados clínicos suficientes para confirmar esses achados em humanos.
6. Efeito antiresortivo do abatacept na remodelação óssea. A atividade osteoclastogênica é aumentada na AR, tanto na articulação, causando erosões ósseas, quanto sistemicamente, atingindo níveis associados à osteoporose generalizada.44,45
Na verdade, um aumento do ativador do receptor ligante do fator nuclear NF-kB (RANKL) tem sido mostrado na membrana sinovial.45,46 O Abatacept dose-dependentemente inibe a formação do osteoclasto murino e a atividade osteoclastogênica avaliada in vitro. Isso foi estudado nos osteoclastos murinos cultivados em placas dentinárias, que mediram o número de pits de reabsorção após 6 dias de adição de diferentes doses de abatacept.47
A droga diminuiu significativamente a área de reabsorção óssea. Estes dados sugerem que o abatacept é uma molécula que liga diretamente as células precursoras dos osteoclastos, inibindo a sua diferenciação. Este mecanismo poderia explicar o efeito anti-erosivo da droga em pacientes com AR. De fato, pacientes tratados com abatacept mostraram uma tendência decrescente no RANK e seus níveis de RANKL ligante na sinóvia, todos associados ao aumento da osteoprotegerina.48 Embora o mecanismo exato subjacente a esta observação não seja claro, estes achados correlacionam-se bem com a melhora radiológica observada em pacientes tratados com abatacept.
7. Efeitos do abatacept em outras células imunes. Embora o APC seja a célula alvo que liga o abatacept e os macrófagos também expressam receptores CD80/86 em sua superfície, há poucos estudos investigando a ação do medicamento sobre a atividade dessas células. De fato, um estudo in vitro recente mostrou que os macrófagos exibiam expressão e tratamento marcado dos receptores CD80/86 com o abatacept reduziu substancialmente a produção de citocinas49. Estes resultados sugerem que o mecanismo de ação do medicamento poderia ser estendido à regulação da linhagem de macrófagos, células-chave na patogênese da doença.
Abatacept também suprime a migração folicular de células T específicas do antígeno e, consequentemente, a colaboração entre células T e células B foliculares no gânglio linfático. Este achado foi observado in situ nos gânglios linfáticos de camundongos BALB/c50. Após a transfusão de tais ratos com células T pré-estimuladas específicas para antígenos, uma imunização subsequente dos ratos mostrou proliferação de células T e migração para a área do linfócito B. Em camundongos tratados com abatacept, a proliferação e migração de células T foi bloqueada, limitando sua presença na maioria dos casos no paracórtex linfonodal. Assim, o tratamento prolongado com o abatacept reduz a proliferação, mobilidade e distribuição de linfócitos de memória autoanticorpos intraganglionares, o que poderia levar à diminuição dos autoanticorpos.
Conclusões sobre o Mecanismo de Ação do Abatacept
Abatacept é uma construção proteica totalmente humanizada, consistindo do domínio extracelular do antígeno T linfocitário humano associado ao antígeno 4 (CTL4) e um fragmento geneticamente modificado da região Fc da IgG1, O medicamento inibe a activação das células T bloqueando selectivamente a ligação específica do CD80/CD86 ao receptor CD28 e, portanto, inibindo a proliferação de células T e as respostas imunitárias dos linfócitos B. Esta acção farmacológica resulta na diminuição dos níveis de mediadores inflamatórios em doentes com AR e numa resposta clínica segura e eficaz.
Conflito de interesse
Dr. Gabriel Herrero-Beaumont recebeu bolsas de pesquisa da Bristol-Myers-Squibb. Dr. Santos Castañeda recebeu bolsas de educação e pesquisa da Abbott, MSD e Pfizer.