- Introduction
- Materiais e Métodos
- Materiais e Químicos
- Preparação da linha celular
- Preparação de zebrafish
- Ensaio de viabilidade celular e observação morfológica
- Análise de apoptose por coloração DAPI e citometria de fluxo
- Xenograft Animal Assay
- Análise de PCR em Tempo Real (qPCR)
- Análise Western Blot (WB)
- Análise estatística
- Resultados
- Efeito Anti-Proliferativo da TF
- Pro-Apoptotic Effect of TF
- In Vivo Efeito da TF no Xenograft Zebrafishes
- Acção molecular da TF nas expressões de mRNA em células A375
- Ação molecular da TB nas expressões de proteínas em A375 Células
- Discussão
- Conclusão
- Data Availability Statement
- Declaração de Ética
- Contribuições do Autor
- Funding
- Conflito de Interesses
- A abreviações
Introduction
Melanoma é um tipo fatal de câncer de pele, com alto potencial metastático e intractabilidade (Yang et al., 2018). Os doentes com melanoma em fases avançadas são sempre inconectáveis e têm um prognóstico pior (Leonardi et al., 2018). A quimioterapia é o pilar do tratamento clínico do melanoma, mas a eficácia da quimioterapia é limitada devido aos seus efeitos colaterais nos tecidos saudáveis (Oliveira Pinho et al., 2019). Recentemente, várias imunoterapias, incluindo inibidores dos receptores CTLA-4 ou PD-1, foram desenvolvidas como novas opções de tratamento do melanoma, mas suas eficiências não são confiáveis e seus efeitos colaterais ainda não são negligenciáveis (Rodríguez-Cerdeira et al., 2017). Portanto, novas estratégias com eficácia e segurança satisfatórias são urgentemente necessárias. A medicina tradicional chinesa (MTC) é uma abordagem complementar e tem sido clinicamente aplicada há milhares de anos, possuindo certa eficácia e menos efeitos colaterais. De acordo com a teoria da MTC, o câncer está associado ao acúmulo de muco, toxinas ou inflamação, e as ervas antiflema, antitóxicas ou anti-inflamatórias podem ter efeitos anticancerígenos (Wang e Cheng, 2019). A teoria tem sido apoiada por muitos casos. Por exemplo, a curcumina em Rhizoma Curcumae longae exerceu efeitos citotóxicos induzindo apoptose e inibindo a angiogênese das células do melanoma (Mirzaei et al., 2016), e a vitexina em Vitex negundo suprimiu o crescimento das células do melanoma induzindo danos no DNA e aumentando os níveis de ROS (Liu et al., 2018). Portanto, os componentes herbais da MTC têm grande potencial para tratamento de cânceres, como o melanoma.
Tea é uma das bebidas mais prevalentes no mundo. É conhecida não só pelo sabor peculiar, mas também pelos benefícios para a saúde. Devido à diferença de processo, o chá tem três tipos principais, incluindo chá verde não fermentado, chá oolong parcialmente fermentado, e chá preto totalmente fermentado ou chá pu-erh (Kuo et al., 2005). As folhas de chá têm sido caracterizadas como uma erva de MTC com propriedades anti-frangulamento e antitóxicas, indicando o seu potencial anti-cancerígeno. Estudos modernos relataram que a bebida de chá é eficaz na prevenção e tratamento de cânceres (Jin et al., 2018). Recentemente, descobriu-se que os polifenóis do chá possuem atividade anticancerígena, que tem efeito superior ao da bebida do chá (Mao et al., 2019). A teaflavina (TF) é um componente do polifenol produzido pela oxidação das catequinas das folhas de chá durante a fermentação, actuando como pigmento principal para a cor, sabor e bioactividade do chá (Roberts et al., 1957). É capaz de induzir apoptose em várias linhas de células cancerígenas, tais como linhas de células cancerígenas da mama humana (MCF-7, MDA-MB-231, T47D, e ZR-75-1), linhas de células cancerígenas do cólon (HCT-15 e HT-29), e linhas de células cancerígenas hepáticas (HCCLM3 e Huh-7), indicando o potencial anticancerígeno (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Entretanto, pouca atenção tem sido dada ao seu efeito sobre o melanoma até agora.
Tendo em vista os efeitos pró-apoptóticos relatados da TF em muitas linhas de células cancerígenas (Lahiry et al., 2008), nós apresentamos uma hipótese de que a TF exerce efeitos pró-apoptóticos sobre as células do melanoma. Para verificar isto, os presentes experimentos in vitro realizados para avaliar o efeito pró-apoptótico citotóxico da TF em células de melanoma humano e realizado experimento in vivo usando um modelo de xenoenxerto em zebrafishes larvares para determinar seu efeito inibidor do tumor. Além disso, o mecanismo da TF também foi explorado.
Materiais e Métodos
Materiais e Químicos
Theaflavin (TF, >95% de pureza) foi fornecido por Theabio Co., Ltd (Hangzhou, China) (Número do lote: 20181211061). Dulbecco′s modificado Eagle′s médio (DMEM) contendo glicose alta (4,5 g/l) foi obtido dos Laboratórios HyClone (UT, EUA). O soro fetal bovino (FBS) foi obtido do Cell Max (Beijing, China). Tripsina (0,25%) foi obtida de Gibco (NY, EUA). 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio brometo (MTT) e dimetil sulfóxido (DMSO) foram obtidos de Sigma (St. Louis, MO, EUA). Anexoin-V: O kit de detecção de apoptose FITC foi obtido de BD Biosciences (CA, EUA). A solução de coloração 4′-6-diamidino-2-fenilindole (DAPI) foi obtida da Thermo Fisher Scientific (MA, EUA). Os anticorpos primários foram obtidos da Cell Signaling Technology (MA, EUA). O reagente Trizol e o kit de reacção em cadeia da polimerase em tempo real (PCR em tempo real) foram obtidos de TaKaRa (Dalian, China).
Preparação da linha celular
Fibroblasto cutâneo HFF-1 humano e a linha celular de melanoma A375 foram obtidos de Shanghai Cell Bank of Chinese Academy of Sciences (Shanghai, China), e a linha celular de melanoma humano A875 foi obtida de Kunming Cell Bank of Chinese Academy of Sciences (Kunming, China). Estas linhas de células foram cultivadas em meio DMEM contendo 10% de FBS a 37°C em uma incubadora umidificada de 5% de CO2. O meio foi mudado diariamente, e as células foram tratadas com TF em sua fase de crescimento logarítmico.
Preparação de zebrafish
Cepa AB de zebrafishes do tipo selvagem foi obtida do China Zebrafish Resource Center, Institute of Hydrobiology, China Academy of Science (Wuhan, China) e acreditada pela Association for Assessment and Accreditation of Laboratory Animal Care International (SYXK 2012-0171). Os zebrafishes larvais a 2 dpf (dias pós fertilização) foram produzidos por acasalamento natural e alojados numa instalação de aquacultura controlada por luz com um fotoperíodo padrão de 14:10 h dia/noite e alimentados com camarão vivo em salmoura duas vezes por dia e flocos de alevins uma vez por dia.
Ensaio de viabilidade celular e observação morfológica
Realizaram-se ensaios de TFTT para determinar os efeitos inibidores da TF nas linhas celulares do melanoma, como descrito anteriormente (Zhou et al.., 2017). As células foram semeadas em placas de 96 poços a 6×103 células/poço em 200 μl meio para adesão 24h, seguido de tratamento com TF em concentrações de 0, 50, 100, 150, 200, 250, 300, e 400 μg/ml para 24, 48, e 72 h. Então 20 μl de solução de MTT (5,0 mg/ml) foi adicionado a cada poço e incubado a 37°C por 4h. Foi adicionado DMSO (150 μl) em cada poço e o valor da densidade óptica (valor OD) foi medido a 490 nm com leitor de microplaca Biorad (CA, EUA). Taxa de inibição (%) = × 100%. As concentrações inibitórias de 50% (IC50) para 24, 48, e 72 h foram calculadas por análise de regressão. Assim, 120, 240 e 360 μg/ml (232,3, 464,7 e 697,0 μM) foram designados como baixas, médias e altas doses de TF. Em seguida, as linhas de células HFF-1, A375 e A875 foram semeadas em placas de 96 poços como acima, e tratadas com dose média de TF às 24 h. A morfologia celular das células A375 foi observada sob microscópio de fluorescência Carl Zeiss (Göttingen, Alemanha).
Análise de apoptose por coloração DAPI e citometria de fluxo
A apoptose celular foi determinada por coloração DAPI e citometria de fluxo baseada na coloração anexin-V/PI. Para a coloração DAPI, células A375 foram semeadas em placas de 96 poços e tratadas com TF em baixas, médias e altas concentrações por 24 h, seguidas de fixação com paraformaldeído a 4% em PBS por 30 min à temperatura ambiente e coloração com DAPI por 10 min no escuro. Após três lavagens, as células foram observadas usando cinco lamelas sob o microscópio de fluorescência Carl Zeiss (Göttingen, Alemanha) e as células apoptóticas foram contadas. A citometria de fluxo foi conduzida de acordo com a instrução manufacturer′s. Em resumo, as células A375 foram semeadas em placas de 6 poços a 3×105 células/poço durante 24 h e tratadas com TF em baixas, médias e altas concentrações durante mais 48 h. Posteriormente, as células foram lavadas duas vezes e rotuladas com solução de anexina V-fluoresceína isotiocianato e PI em tampão de ligação. A intensidade da fluorescência das células foi detectada pela citometria de fluxo BD C6 (CA, EUA). A análise foi replicada e as taxas de células apoptóticas iniciais e tardias (%) foram calculadas.
Xenograft Animal Assay
Para determinar a faixa de dose de TF, foram usados zebrafishes larvais totalmente 300 a 3 dpf e cultivados aleatoriamente em placas de 6 poços com 30 peixes cada. Os TF foram dissolvidos em cada poço a 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1,000, e 2,000 μg/ml, respectivamente, durante 24 h. Posteriormente foram observados peixes de cada grupo sob um microscópio estereoscópico para registar a mortalidade e os eventos adversos. Conforme descrito pelo nosso estudo anterior, nenhum nível de efeito adverso observado (NOAEL) de TF foi estimado, e 1/9 NOAEL, 1/3 NOAEL e NOAEL foram aplicados como doses baixa, média e alta para o seguinte experimento (Jin et al, 2018).
Para estabelecer o modelo de xenoenxerto, células A375 foram coradas com CM-Dil (fluorescência vermelha) a uma diluição de 1:1.000 e microinjetadas no saco vitelino de zebrafishes larvais (2 dpf) a uma dose de 200 células/peixe. Após o crescimento do tumor durante 24 h, todos os peixes foram observados sob um microscópio fluorescente (AZ100, Nikon, Tóquio, Japão) para verificação do modelo. Os peixes A375 foram agrupados em 5 grupos (30 peixes cada) e tratados com 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL, e NOAEL de TF, assim como 15 μg/ml (50 μM) de cisplatina, respectivamente, durante 24 h. A intensidade de fluorescência (FI) da massa celular A375 de zebrafishes foi detectada e a taxa inibitória foi calculada como: taxa inibitória (%) = × 100%.
Análise de PCR em Tempo Real (qPCR)
Para revelar as ações moleculares de TF em células A375, qPCR foi empregado em um ABI QuantStudio™ 7 Flex Real-Time PCR System (Applied Biosystems, CA, EUA). O RNA total de células A375 foi extraído usando reagente Trizol e sintetizado para cDNA via transcrição reversa. O sistema de reacção qPCR teve um volume 20.0 μl: 10 μl SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0.8 μl PCR forward primer, 0.8 μl PCR reverse primer, 2.0 μl cDNA modelo, 0.4 μl corante de referência ROX, e 6.0 μl ddH2O. A condição de reacção qPCR foi definida para 95°C para 30 s de desnaturação inicial, 40 ciclos de 95°C para 5 s de desnaturação, 60°C para 34 s de recozimento, e 72°C para 40 s de extensão. No final de cada reação, foi realizada uma análise da curva de fusão. β-ACTIN foi utilizado como gene de referência e o método 2-ΔΔCT foi aplicado para analisar a expressão relativa de cada gene (Tabela 1).
 >
>
Table 1 Primer sequências utilizadas para análise qPCR.
Análise Western Blot (WB)
A expressão proteica das células A375 com tratamento TF em 0 μg/ml e 120 μg/ml (232.3 μM) foi analisada pela análise WB. As proteínas totais foram extraídas utilizando um tampão de lise (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1% Triton, 0,1% SDS, 5 μg/ml de leupeptina, e 1 mM PMSF) durante 30 min em gelo com congelamento e descongelamento repetidos. As proteínas alvo foram separadas por eletroforese em gel de poliacrilamida de dodecil sulfato de sódio desnaturalizado (SDS-PAGE) (8~12%) e depois transferidas para uma membrana de fluoreto de polivinilideno (PVDF) (Millipore, MA, EUA). A membrana foi bloqueada com 5% de leite sem gordura durante 2 h, seguida de incubação nocturna a 4°C com os anticorpos contra os mesmos: ACTIN, ASK1, ATM, ATM fosforilada (p-ATM), ATR, ATR fosforilada (p-ATR), caspase clivada 3 (c-CASP3), caspase clivada 8 (c-CASP8), CHK1, CHK2, fosforilada CHK1 e CHK2 (p-CHK1 e p-CHK2), JNK, JNK fosforilado (p-JNK), C-JUN fosforilado, C-JUN fosforilado (p-C-JUN), PARP clivado (poli ADP-ribose polimerase), P53, e P53 fosforilado (p-P53). Após incubação com o anticorpo secundário, estas proteínas foram visualizadas com um kit de quimioluminescência melhorado (Amersham Pharmacia Biotech, Little Chalfort, UK) e detectadas usando um analisador de quimioluminescência.
Análise estatística
Os dados foram expressos como valores médios ± DP e submetidos à ANOVA unidirecional, seguida pela comparação da diferença menos significativa (LSD) de Fisher. Todas as análises foram realizadas utilizando uma versão atualizada do software DPS (Tang e Zhang, 2013).
Resultados
Efeito Anti-Proliferativo da TF
Como mostrado na Figura 1A, TF em 50 μg/ml (96.8 μM) inibiu significativamente a viabilidade das células A375, e as taxas inibitórias foram aumentadas com o aumento das concentrações de TF de 50 para 400 μg/ml (96,8 para 744,4 μM) (cada P < 0,01 em relação ao nível normal), indicando uma forma dependente da concentração. As taxas inibitórias também foram aumentadas com o tratamento de TF de 24 para 72 h, com IC50 de 218,9 para 84,9 μg/ml (423,8 para 164,4 μM), respectivamente. Em seguida, aplicamos 120, 240 e 360 μg/ml (232,3, 464,7 e 697,0 μM) como as doses de TF-L, TF-M e TF-H, respectivamente. Como mostrado na Figura 1B, a TF-M obviamente inibiu a viabilidade das células A375 e A875, mas exerceu pouco efeito sobre as células HFF-1. Como mostrado na Figura 1C, a morfologia das células A375 foi obviamente alterada e o número de células vivas foi diminuído com o tratamento de TF em concentrações crescentes.

Figure 1 Viabilidade celular das células A375 com tratamento de TF às 24, 48, e 72 h (A), viabilidade celular das células HFF-1, A375, e A875 com tratamento de TF às 24 h (B), e morfologia das células A375 com tratamento de TF às 24 h (C). Os dados foram a média ± DP (n = 5). Por meio da diferença menos significativa de Fisher (LSD) comparações múltiplas, dados (média ± DP) com a mesma letra minúscula (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d) não indicam diferença significativa entre si, enquanto dados com letras diferentes (a vs. b vs. c vs. b vs. e vs. f vs. g) indicam diferença significativa entre si. Barra de escala = 200 μm.
Pro-Apoptotic Effect of TF
DAPI staining and flow cytometry were performed to evaluate the pro-apoptotic effect of TF on A375 cells. O resultado da coloração DAPI mostrou morfologia apoptótica, incluindo forma encolhida, cariopnose e fragmentação nuclear, em células A375 com tratamento de TF de 120 a 360 μg/ml (232,3 a 697,0 μM) (Figura 2A). O número de células apoptóticas foi significativamente aumentado com o tratamento com TF de 240 e 360 μg/ml (464,7 e 697,0 μM) (cada P < 0,01 vs. NC) (Figura 2C). O resultado da citometria de fluxo mostrou apoptose precoce induzida por TB e apoptose tardia de células A375 (Figura 2B). O número de células apoptóticas precoces e tardias foi aumentado com o tratamento de TF de 120 para 360 μg/ml (232,3 para 697,0 μM) (Figura 2B), e suas proporções foram significativamente maiores com o tratamento de TF em 360 μg/ml (697,0 μM) (P < 0,01 e P < 0,05 vs. nível normal) (Figuras 2D, E). Os resultados indicaram que o TF induziu apoptose de células A375 de forma dependente da concentração.
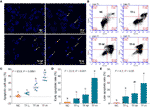
Figure 2 DAPI observação da coloração (A) e análise da citometria de fluxo (B) em células A375 com tratamento com aaflavina (TF). Análise estatística da taxa de células apoptóticas (C), análise estatística da taxa apoptótica precoce (D) e análise estatística da taxa apoptótica tardia (E). Por meio da diferença menos significativa de Fisher (LSD) comparações múltiplas, dados (média ± DP) com a mesma letra minúscula (a vs. ab; ab vs. b; b vs. b; c vs. c) não indicam diferença significativa entre si, enquanto dados com letras diferentes (a vs. b vs. c) indicam diferença significativa entre si. Barra de escala = 100 μm.
In Vivo Efeito da TF no Xenograft Zebrafishes
As curvas de mortalidade e eventos adversos dos zebrafishes com tratamento de TF foram mostradas na Fig. 3A. A morte dos peixes foi causada pela TF em 31,25 μg/ml (60,5 μM), e nenhum peixe sobreviveu com TF em 125 μg/ml (242,0 μM), indicando a dose máxima não letal de TF inferior a 31,25 μg/ml (60,5 μM). Os eventos adversos, incluindo o rolar anormal do corpo e edema, foram observados com tratamento de TF de 3,47 μg/ml (6,7 μM) para suas doses mais altas, indicando o NOAEL de TF inferior a 3,47 μg/ml (6,7 μM). Após testes replicados, o NOAEL foi finalmente estimado em 2,0 μg/ml (3,9 μM). Assim, 0,22, 0,67, e 2,0 μg/ml (0,4, 1,3, e 3,9 μM) foram usados como as doses baixa, média, e alta de TF para a experiência subsequente.
Como mostrado na Figura 3B, um modelo de xenoenxerto de células A375 foi estabelecido em zebrafishes larvares e as intensidades fluorescentes da massa celular nos peixes foram testadas. Após 24 h de tratamento, a TF de 0,22 a 2,0 μg/ml (0,4, 1,3, e 3,9 μM) inibiu obviamente o crescimento do tumor A375, com taxas inibitórias de 1,0 a 46,4%. Os efeitos inibitórios da TF em 0,67 e 2,0 μg/ml (1,3 e 3,9 μM) foram significativos, se comparados com o grupo modelo (P < 0,01), e o efeito da TF em 2,0 μg/ml (3,9 μM) foi ainda maior do que o da cisplatina em seu NOAEL (50 μM).
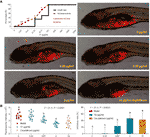
Figure 3 Mortalidade e eventos adversos dos zebrafishes larvais induzidos pelaaflavina (TF) e observação dos zebrafishes larvais xenotransplantados com células A375 com tratamento de TF ou cisplatina (A), assim como a intensidade de fluorescência e taxas inibitórias da TF (B). A área fluorescente em vermelho representa a massa celular A375. Por meio de comparações múltiplas de LSD, dados (média ± DP) com a mesma letra minúscula (a vs. a; c vs. c) não indicam diferença significativa entre si, enquanto dados com letras diferentes (a vs. b vs. c) indicam diferença significativa entre si.
Acção molecular da TF nas expressões de mRNA em células A375
As expressões relativas de mRNA dos genes alvo da TF foram testadas pelo ensaio qPCR. Como mostrado na Fig. 4, as expressões de BAX, BIM, C-MYC, P21, P53, e PUMA foram significantemente reguladas por TF (cada P < 0,01 vs. nível NC), exceto para aquela de BAX com tratamento de TF em sua baixa concentração. Embora a expressão do BCL-2 tenha sido aumentada pela TF, as proporções de BAX/BCL-2 foram significativamente maiores com tratamento de TF em suas concentrações médias a altas do que a do nível NC (P < 0,01), indicando o maior papel do BAX na ação da TF.
Ação molecular da TB nas expressões de proteínas em A375 Células
WB foi aplicada para determinar a expressão e fosforilação das proteínas visadas pela TF. Como mostrado na Figura 5, as expressões de ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8, e c-CASP3 foram significativamente melhoradas pela TF em 120 μg/ml (232.3 μM) (cada P < 0.01 vs. nível NC). Além disso, as ações da TF sobre ATR, p-ATR, CHK2, P53, C-JUN (43 kd), e p-C-JUN (Ser 73) foram insignificantes (cada P > 0.05 vs. nível NC).
Discussão
Embora as atividades anticancerosas da TF tenham sido bem documentadas (Sur e Panda, 2017; Takemoto e Takemoto, 2018; Sajadimajd et al, 2020), o conhecimento da sua eficácia no melanoma ainda é pouco. Para preencher esta lacuna, o presente estudo realizou experiências in vitro e in vivo para estudar os efeitos e mecanismos da TF contra as células do melanoma. Pela primeira vez, demonstramos os efeitos pró-apoptóxicos citotóxicos e inibidores tumorais da TF sobre as células do melanoma A375. Seu mecanismo foi sugerido para ser associado às vias do P53 e JNK. A inovação deste estudo é a descoberta da eficácia do TF′s anti-melanoma, enquanto os relatórios anteriores focalizaram apenas TF′s efeitos sobre outros tumores (Lin, 2002; Sur e Panda, 2017). Além disso, este é também o primeiro relatório sobre a acção molecular da TF na via JNK, enquanto que o mecanismo associado à via P53 de TF′s efeito pró-apoptótico nas células cancerígenas foi previamente relatado (Lahiry et al., 2008).
Recentemente, os modelos tumorais de xenoenxertos utilizando zebrafishes larvais têm atraído cada vez mais atenção para os estudos anti-cancerígenos, devido às vantagens dos zebrafishes larvais em comparação com outros modelos animais: (1) a falta de rejeição imunológica contra células humanas proporciona maior taxa de sucesso para xenotransplante; (2) a transparência corporal proporciona observação visível in vivo do crescimento tumoral e da toxicidade das drogas; e (3) a geração em larga escala e a organogênese rápida proporcionam períodos experimentais mais curtos (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). Neste estudo, a TF exerceu efeito inibitório dose-dependente na massa tumoral A375 em zebrafishes larvares (Figura 3B), com taxa inibitória de 46,4% em seu NOAEL (3,9 μM). A taxa inibitória foi maior que a da cisplatina, indicando que a TF foi mais efetiva que a cisplatina dentro de sua respectiva faixa de dose segura. Além disso, a taxa inibitória foi maior que a de outro pigmento do chá (theabrownin) (Jin et al., 2018), sugerindo a TF como o componente mais eficaz do chá. No entanto, a gama de dose efectiva in vivo (1,3 a 3,9 μM) da TF é muito inferior à sua gama de dose efectiva in vitro (96,8 a 774,4 μM). A razão para tal diferença pode ser que, após a administração oral, os derivados metabolizados de TF têm um efeito mais elevado do que o da TF. Isto indica que a aplicação oral pode ser mais eficiente que outras vias de TF.
De acordo com a regra de conversão de dose, as doses efetivas (1,3 e 3,9 μM) de TF em zebrafishes larvais podem ser estimadas como 0,03 a 0,09 mg/kg em humanos (Zhang et al., 2003). Isto sugere que a administração oral de TF em tão baixa dose pode ser eficaz no tratamento de pacientes com melanoma, indicando uma boa relação custo-eficácia deste composto. Até o nosso conhecimento, existem apenas alguns poucos relatos sobre a aplicação clínica da TF. Um ensaio em grupo paralelo duplo-cego, aleatório, controlado por placebo, aplicou extrato de chá verde enriquecido com TF para tratar pacientes com hipercolesterolemia leve a moderada durante 12 semanas (Maron et al., 2003). Nesse estudo, a ingestão diária de TF foi de 75 mg em extrato de chá verde, o que reduziu significativamente o colesterol total, colesterol LDL e triglicérides em adultos hipercolesterolemicos sem observação de eventos adversos significativos (Maron et al., 2003). Neste estudo, a faixa de dose efetiva de TF foi muito menor que a relatada, sugerindo um maior potencial de TF para o tratamento do melanoma em clínica. Entretanto, embora a faixa de dose efetiva da TF fosse pequena, seu limiar de dose letal para larvas de zebrafish também era baixo (<60,5 μM) e era menor que outros pigmentos de chá (Figura 3A) (Jin et al., 2018), deixando uma preocupação com a toxicidade potencial da TF para os seres humanos. Curiosamente, descobrimos que a TF exerceu pouco efeito sobre a linha celular normal (fibroblasto cutâneo HFF-1) (Figura 1B), sugerindo uma viabilidade clínica para seu uso externo que pode evitar a potencial toxicidade de seu uso interno.
Nossa experiência mecanicista mostrou que a TF ativou ATM, CHK1/2, P53, CASP8/3 na via P53 e também ativou ASK1, JNK, e C-JUN na via JNK, associando-se à apoptose celular A375. A apoptose foi determinada pela coloração DAPI e análise citométrica de fluxo em nível celular (Figura 2) e mediada pela superexpressão dos genes pró-apoptóticos (P53, BAX, BIM e PUMA) e pela ativação de proteínas relacionadas à apoptose (caspases e PARP) em nível molecular (Figuras 4 e 5). P53 (TP53) codifica uma fosfoproteína nuclear de ligação ao DNA com atividade supressora de tumores, que atua como fator de transcrição no centro de uma rede para o controle da apoptose em resposta às tensões celulares (Martin et al., 2002). Ela ativa a apoptose estimulando a transcrição de genes da família Bcl-2, como BAX, BIM e PUMA (Levine e Oren, 2009). BAX e BIM codificam membros pró-apoptóticos que provocam apoptose e morte celular, ativando a cascata de caspase em resposta a estímulos apoptóticos (Rossé et al., 1998; Youle e Strasser, 2008). PUMA, como um modulador de apoptose P53, codifica uma proteína contendo domínio BH3 que se localiza na mitocôndria, interage com Bax e Bak, e ativa a cascata caspase por clivagem do CASP3 (Nakano e Vousden, 2001; Letai, 2009). Neste estudo, CASP8 e CASP3 foram clivados em resposta à ativação do P53. CASP8 é uma caspase iniciadora na cascata apoptótica, que ativa CASP3 para fragmentação apoptótica do DNA, resultando em clivagem subsequente da PARP (c-PARP) para executar o processo apoptótico (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP é responsável pela reparação do DNA e viabilidade celular em resposta ao estresse exógeno (Satoh e Lindahl, 1992). Ela pode ser clivada pelo CASP3 e assim facilita a desmontagem celular na apoptose (Oliver et al., 1998). Assim, a quantidade de PARP (c-PARP) clivada pode ser usada como marcador da apoptose celular.
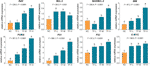
Figure 4 Expressão relativa do mRNA daaflavina (TF)-gens alvo em células A375 após 24 h de tratamento. Por meio da diferença menos significativa de Fisher (LSD) comparações múltiplas, dados (média ± SD) com a mesma letra minúscula (a vs. a; b vs. b; c vs. c) não indicam diferença significativa entre si, enquanto dados com letras diferentes (a vs. b vs. c vs. d) indicam diferença significativa entre si.
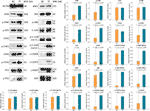
Figure 5 Expressão e fosforilação das proteínas alvo daaflavina (TF) em células A375 após 24 h de tratamento. Dados (média ± DP) com diferentes letras minúsculas são significativamente diferentes entre si nas comparações múltiplas da diferença menos significativa (LSD) de Fisher.
Em nossos estudos anteriores, relatamos que a indução de danos no DNA foi associada com o mecanismo pró-apoptótico mediado pela via P53 da theabrownin (Wu et al., 2016; Jin et al., 2018). No entanto, embora tanto a via P53 ativada pela TF quanto a teabrownina e a apoptose de células tumorais induzidas, não encontramos indução de dano ao DNA com tratamento da TF neste estudo. Alternativamente, encontramos a ativação da cascata ASK1-JNK-C-JUN, que também funciona como via apoptótica. Neste módulo de sinalização, a ASK1 (apoptose sinalizadora da cinase 1) é uma proteína cinase ativada por mitógeno que desempenha um papel fundamental na apoptose induzida por citocondria e estresse, desencadeando a via mitocondrial dependente (Matsuzawa e Ichijo, 2001; Zhang et al., 2003). Ela ativa a sinalização JNK a jusante em resposta a diferentes tipos de estresse, levando à apoptose celular através da ativação de C-JUN e subsequente superexpressão de genes pró-apoptóticos (Tobiume et al., 2001). Quimioterápicos, como cisplatina, docetaxel e paclitaxel, têm sido relatados para induzir apoptose de células melanoma através da via JNK independente da via P53 (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). Isto indica que a TF pode ter uma vantagem em relação a estas drogas devido ao seu mecanismo de ação mediado pela via dupla, o que foi demonstrado preliminarmente pelos efeitos inibidores tumorais mais elevados da TF do que da cisplatina neste estudo. No entanto, existem algumas limitações deste estudo, como se segue: (1) as ações das vias P53 e JNK no mecanismo proposto de dupla via mediada da TF não foram verificadas; (2) a interação entre as vias P53 e JNK não foi investigada, e qual via desempenha o papel principal é desconhecida; e (3) a faixa de dose in vitro e a faixa de dose in vivo são bastante diferentes, o motivo disso foi explicado, mas necessita de evidências experimentais. Para abordar estas questões, são necessários mais estudos no futuro. Por exemplo, os siRNAs ou inibidores de P53 e JNK devem ser utilizados para verificar as acções destas vias e explorar a interacção entre si, e os metabolitos séricos de TF devem ser quimicamente analisados e farmacologicamente estudados para testar a nossa hipótese de que os derivados metabolizados de TF têm um efeito superior ao da TF. Além disso, como não há relatos clínicos de TF para o tratamento do câncer, a eficácia terapêutica e benefícios da TF em pacientes com câncer deve ser mais estudada.
Conclusão
Desde que o potencial anticancerígeno da TF foi bem documentado, permanece incerto se a TF é eficaz no tratamento do melanoma. Neste estudo, usando a linha celular do melanoma e o modelo zebrafish do xenoenxerto, encontramos efeitos pró-apoptóxicos citotóxicos e inibidores tumorais da TF sobre as células do melanoma e revelamos seu mecanismo em associação com as ativações das vias do P53 e JNK. Este é o primeiro estudo que descreve os efeitos e mecanismo da TF contra as células do melanoma. Uma vez que o mecanismo da TF não era apenas dependente da via do P53, pode-se esperar que a TF seja eficaz no tratamento das linhas celulares com P53-mutadas. Estudos adicionais são necessários para verificar esta dedução. Ao todo, este estudo fornece evidências da eficácia da TF contra o melanoma, o que contribui para o desenvolvimento de agentes derivados da TF para a terapia do melanoma.
Data Availability Statement
Os dados brutos que suportam as conclusões deste artigo estão disponíveis no autor correspondente, mediante solicitação razoável.
Declaração de Ética
O estudo com animais foi revisado e aprovado pelo Comitê de Ética da Zhejiang Chinese Medical University.
Contribuições do Autor
LeZ realizou o trabalho principal deste artigo. BY conduziu os experimentos celulares e moleculares. LiZ e SM contribuíram para a redação deste manuscrito. A WD forneceu idéias e apoio financeiro para este trabalho. YX conduziu o experimento do zebrafish. LS desenhou este trabalho e redigiu o manuscrito. A TE melhorou o desenho e o rascunho deste trabalho. Todos os autores contribuíram para o artigo e aprovaram a versão submetida.
Funding
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (Subvenção No. 81774331, 81873049, e 81973873), a Fundação Provincial de Ciências Naturais de Zhejiang da China (Subvenção No. 2016ZZ011), a Disciplina de Superioridade Característica da Universidade Provincial de Construção Zhejiang (Farmacologia Tradicional Chinesa), e a Fundação de Abertura da China (Subvenção nº ZYX2018006).
Conflito de Interesses
YX foi empregada pela empresa Hunter Biotechnology, Inc.
Os autores restantes declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
A abreviações
DAPI, 4′-6-diamidino-2-fenilindole; DMEM, Dulbecco′s modificado Eagle′s medium; DMSO, dimetil sulfóxido; dpf, dias pós fertilização; FBS, soro fetal bovino; FI, intensidade de fluorescência; LSD, a diferença menos significativa de Fisher; NOAEL, sem nível de efeito adverso observado; MTT, 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio brometo; PARP, poli ADP-ribose polimerase; SDS-PAGE, electroforese em gel de poliacrilamida de dodecilsulfato de sódio desnaturalizado; TCM, teaflavina; TF, Medicina Tradicional Chinesa.
Adhikary, A.., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Asaflavinas retardam a migração das células cancerosas da mama humana através da inibição do NF-kappaB via p53-ROS. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. (1999). Papel da clivagem da poli(ADP-ribose) polimerase (PARP) na apoptose. Caspase 3-resistente PARP mutante aumenta as taxas de apoptose em células transfectadas. J. Biol. Quimiol. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). Caspase-3 é necessário para fragmentação de DNA e alterações morfológicas associadas à apoptose. J. Biol. Quimiol. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownin desencadeia danos no DNA para suprimir células do osteossarcoma U2OS humano, ativando a via de sinalização p53. J. Célula. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebrafish xenografts como uma ferramenta para estudos in vivo sobre o câncer humano. Ann. Nova Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Estudos comparativos sobre a hipolipidemia e os efeitos supressores do crescimento de folhas de chá oolong, preto, pu-erh, e verde em ratos. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Contribuição da p53-mediated Bax transactivation in theaflavin-induced mamary epithelial carcinoma cell apoptosis. Apoptose 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). As teaflavinas visam vias Fas/caspase-8 e Akt/pBad para induzir apoptose em células humanas com câncer de mama p53-mutadas. Carcinogênese 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Zebrafish: um novo modelo na passarela farmacêutica. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Melanoma cutâneo: Da patogénese à terapia (Revisão). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma ataca Bax. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.200903134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). Os primeiros 30 anos da p53: crescendo cada vez mais complexo. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Asaflavinas inibem a sintase ATP e a cadeia respiratória sem aumentar a produção de superóxidos. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Quimioprevenção do câncer por polifenóis de chá através da modulação das vias de transdução de sinal. Arco. Farmacêutico. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Vitexin composto 1, uma nova extração de uma erva chinesa, suprime o crescimento de células de melanoma através de danos no DNA, aumentando os níveis de ROS. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatina induz a conformação proapoptótica de Bak de forma deltaMEKK1-dependente. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). O chá e seus componentes previnem o câncer: Uma revisão do mecanismo relacionado com o redox. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Cholesterol-lowering effect of a theaflavin-enriched green tea extract: a randomized controlled trial. Arco. Med. Interno. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Integrando dados de mutação e análise estrutural da proteína supressora de tumores TP53. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Mecanismos moleculares da decisão entre a vida e a morte: regulação da apoptose por apoptose sinal-regulador da cinase 1. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Envolvimento do estresse reticulum endoplasmático em apoptose de melanoma humano dependente de JNK induzida por Docetaxel. Apoptose Int. J. Programa. Morte celular 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumina: Um novo candidato à terapia do melanoma? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, um novo gene proapoptótico, é induzido pela p53. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Estratégias nanotecnológicas emergentes para quimioterapia sistêmica contra o melanoma. Nanomater. (Basiléia) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Importância da poli(ADP-ribose) polimerase e sua clivagem na apoptose. Lição de um mutante incleavél. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). Rastreio in vivo de vertebrados de alto rendimento. Nat. Métodos 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). As substâncias fenólicas do chá fabricado. I. Fraccionamento e cromatografia de papel de substâncias solúveis em água. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Avanços na imunoterapia para melanoma: Uma revisão abrangente. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prolonga a sobrevivência celular após a liberação de citocromo induzida por Bax c. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Avanços nos polifenóis naturais como agentes anticancerígenos para o câncer de pele. Farmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Papel da formação de poli(ADP-ribose) na reparação do DNA. Natureza 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). O estresse mitocondrial induzido por taxol nas células melanoma é mediado pela ativação da cinase c-Jun N-terminal (JNK) e vias p38 através da proteína desacoplada 2. Célula. Sinal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Asaflavinas suprimem o crescimento tumoral e a metástase através do bloqueio da via STAT3 no carcinoma hepatocelular. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). Pro-caspase-3 é um importante alvo fisiológico da caspase-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Aspectos moleculares da quimiopreventividade e da eficácia terapêutica do chá e dos polifenóis do chá. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Síntese dasaflavinas e suas funções. Mol. (Basiléia Suíça) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Software Data Processing System (DPS) com desenho experimental, análise estatística e data mining desenvolvido para uso em pesquisa entomológica. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 é necessário para ativações sustentadas de JNK/p38 MAP kinases e apoptose. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Análises sobre a teoria da patogênese da toxina do câncer e a teoria da ‘consolidação da resistência corporal e limpeza da fonte’. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Efeito anti-proliferativo e indutor de apoptose doabrownin contra células não pequenas do adenocarcinoma pulmonar A549. Frente. Farmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). Uma revisão epidemiológica da dieta e do melanoma maligno cutâneo. Epidemiol do câncer. Biomarcadores Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). A família da proteína BCL-2: atividades opostas que medeiam a morte celular. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Zebrafish: um modelo animal para estudos toxicológicos. Moeda. Protoc. Toxicol. Capítulo 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). A teabrownina inibe a progressão do ciclo celular e o crescimento tumoral do carcinoma pulmonar através do mecanismo relacionado ao c-myc. Frente. Farmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar