Introduction
O uso de remédios naturais é uma tradição antiga ainda em prática, com >60% da população mundial a abordar vários problemas de saúde, incluindo o cancro, usando a medicina tradicional como primeira escolha (Sultana et al., 2014). Entretanto, o tratamento do câncer é complexo, e as possibilidades atuais para os pacientes dependem do tipo e estágio do câncer, além da idade, sexo e saúde geral do paciente. Embora a quimioterapia seja geralmente bem sucedida durante os estágios iniciais do câncer, sua eficácia depende do esquema de administração do medicamento e da condição fisiológica do paciente. No entanto, a principal preocupação com a quimioterapia é a sua toxicidade, uma vez que os medicamentos utilizados tendem a afectar tanto as células cancerosas como as células normais, com um elevado índice proliferativo gerando danos colaterais nos pacientes. Além disso, as células cancerígenas podem desenvolver resistência ao tratamento, apresentando metástases, diminuindo assim a resposta ao tratamento e reduzindo a possibilidade de sobrevida livre de doenças. Portanto, um dos principais desafios na descoberta de medicamentos é a eliminação da toxicidade dos agentes quimioterápicos e o desenvolvimento de medicamentos mais eficazes e eficientes para melhorar os tratamentos, os tempos de recuperação e a qualidade de vida geral do paciente.
Os produtos naturais têm fornecido uma rica fonte de estruturas químicas para o desenvolvimento de tratamentos anti-cancerígenos. Na área da farmacologia oncológica, 49% dos medicamentos empregados em quimioterapia são derivados ou inspirados em fontes naturais, como plantas, microorganismos e organismos marinhos (Newman e Cragg, 2016). Exemplos incluem alcalóides vinca e taxanos (agentes aglutinantes de tubulina), além de podofilotoxinas, antraciclinas e etoposídeos (inibidores da topoisomerase) (Da Rocha et al., 2001; Nobili et al., 2009). Estes exemplos ilustram o potencial dos produtos naturais na descoberta de drogas.
As AAs são metabólitos secundários produzidos pela família Annonaceae (Figura 1). Na medicina tradicional, o fruto do gênero Annona é usado para o tratamento da febre, dor, reumatismo, diarréia e artrite, e suas folhas para diabetes, dores de cabeça e insônia (Moghadamtousi et al., 2015a). Annona reticulada tem sido empregada na África como um tratamento anti-istérico e anti-helmíntico, e A. squamosa é usada na Índia para o tratamento de várias condições, incluindo tumores malignos (Savithramma et al., 2011). Além disso, A. muricata é um remédio medicinal popular na América, África e Índia para o tratamento do câncer (Moghadamtousi et al., 2015a), enquanto no México, A. macroprophyllata, A. muricata e A. purpurea são usados para o tratamento de tumores de pele e câncer gástrico (Alonso-Castro et al., 2011; Brindis et al., 2013). Segundo uma revisão etnofarmacológica de plantas medicinais no México, o gênero Annona também poderia ser explorado para o tratamento do câncer de cólon (Jacobo-Herrera et al., 2016). Esta evidência indica que os AAs são moléculas com potencial bioativo significativo.

Figure 1 Acetogeninas núcleo: lineal, epóxico, mono-tetrahidrofurano (THF), bis-THF, e tris-THF.
Superior a 500 AAs foram descritos até à data; estes compostos são caracterizados por uma longa cadeia alifática com um anel α, β-insaturado γ-lactone e anéis 0-3 tetrahidrofurano (THF) (Yuan et al., 2015), e mostraram actividade citotóxica contra diferentes linhas de células cancerígenas humanas (i.e., pulmão, mama, cólon, rim, pâncreas, próstata, fígado e bexiga) (revisto em Zeng et al, 1996; Chávez e Mata, 1998; Wang et al., 2002; Yuan et al., 2003; Mangal et al., 2016; Miao et al., 2016a; Miao et al., 2016b) além da atividade antitumoral in vivo (Chen et al., 2012a; Chen et al., 2012b). Aqui, revisamos os relatórios mais recentes sobre AAs na área de descoberta de medicamentos-oncologia.
Materiais e Métodos
Realizamos uma pesquisa na base de dados do PubMed usando os seguintes termos de palavras-chave “acetogeninas e câncer”, “atividade antitumoral das acetogeninas”, “citotoxicidade das acetogeninas”, e “mecanismo de ação das acetogeninas”, entre outras combinações. Revisamos artigos publicados nos últimos 15 anos que foram baseados em dois critérios: plantas com uso medicinal e a metodologia do fracionamento guiado pelo bioensaio. Os dados in vitro aqui relatados são baseados exclusivamente na atividade de compostos puros, enquanto para estudos in vivo, extratos de ervas também foram considerados devido à falta de ensaios em modelos animais.
Resultados e Discussão
Estudos In Vitro
No campo dos produtos naturais, a busca por moléculas bioativas tende a envolver um fracionamento de extratos guiado pelo bioensaio para encontrar a molécula mestre ou moléculas responsáveis pela atividade. No entanto, muitos metabolitos secundários podem ter como alvo múltiplas marcas de cancro. Em geral, a indústria farmacêutica está interessada em medicamentos que apresentam mais de uma interação molecular e englobam vários alvos moleculares.
Acetogeninas são moléculas com grande potencial para a futura terapia do câncer. A sua actividade biológica mais proeminente é a inibição do complexo mitocondrial I devido à sua estrutura de bis-THF. De fato, foi relatado anteriormente que as AAs mono-THF contendo uma cadeia alquílica que liga a moita lactona ao grupo THF são inibidores não competitivos do Complexo I (ou seja, NADH: ubiquinona oxidoreductase) na cadeia respiratória, o que leva a um bloqueio da oxidação fosforescente e uma subseqüente diminuição na produção de ATP (Tormo et al., 1999; Chen et al., 2012). Tal inibição envolve um grande grupo de vias que podem induzir a morte celular, incluindo apoptose e autofagia, ou agir em outras redes metabólicas como inibidores da enzima lactato desidrogenase A, como um antioxidante, ou por meio da parada do ciclo celular.
Mais, A. muricata (Moghadamtousi et al.., 2015a) e A. squamosa L. (Chen et al., 2012a; Chen et al., 2012b; Chen et al., 2012c; Chen et al., 2016) foram relatados como tendo actividade citotóxica contra várias linhas de células cancerígenas humanas ou de outros mamíferos. Particularmente, as anosquatinas AAs A (1) e B (2) exibem seletividade para as linhas celulares MCF-7 e A-549, respectivamente (Chen et al., 2012c). A Tabela 1 mostra as AAs mais recentemente descobertas exibindo atividade citotóxica, além de outros compostos menos recentes que exibem atividade antineoplásica in vivo (Tabela 2).
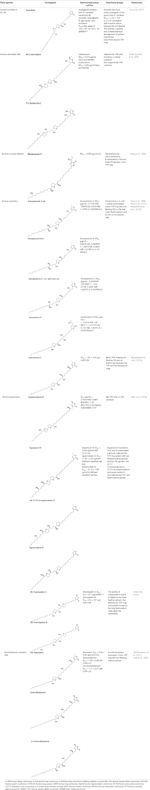
Tabela 1 Atividade citotóxica das acetogeninas in vitro em diferentes linhas celulares cancerígenas.

Tabela 2 Actividade citotóxica in vivo das acetogeninas e extractos seleccionados ricos em acetogeninas.
Apoptose é uma estratégia natural de morte celular que mata células desnecessárias ou danificadas. Os principais genes envolvidos neste processo são o p53 e a família bcl2; o primeiro é um supressor tumoral, enquanto o último pode ser proapoptótico (BAD, BAX e BAK entre outros) ou antiapoptótico (bcl2 e bcl-x) (Okada e Mak, 2004). A função primária da p53 é evitar a replicação de células com danos no DNA. Portanto, o p53 está inativo, e as células danificadas continuam a crescer e a replicar mutações de DNA, resultando em doenças como o câncer (Igney e Krammer, 2002; Okada e Mak, 2004). Assim, pesquisas realizadas até o momento podem ser classificadas em dois tópicos principais: indução de apoptose ou mecanismos de resistência à apoptose.
As quimioterapias indutoras de apoptose atuais causam efeitos secundários graves nos pacientes. Como tal, a busca de drogas menos tóxicas é uma prioridade e espera-se que os produtos naturais ajudem no desenvolvimento de drogas moduladoras da apoptose. Neste contexto, as AAs aumentam a regulação da atividade da caspase 3 e 8 (efeitos da apoptose), ao mesmo tempo em que diminuem a expressão de sobrevivência e Bcl-2, aumentando assim a apoptose. A anonacina AA (3) promove a apoptose nas células cancerosas ativando as vias da caspase 3 e Bax (Yuan et al., 2003), enquanto a escamocina induz a apoptose através da expressão dos genes proapoptóticos Bax e Bad, o que resulta na clivagem da PARP e no aumento da atividade da caspase 3 nas células cancerosas T24 da bexiga (Yuan et al., 2006). Isto contrasta com resultados anteriores onde a escamocina não induziu apoptose nas células cancerosas da mama mas inibiu a proliferação ao bloquear o ciclo celular na fase G1 (Raynaud et al., 1999).
O extrato de metanol de A. reticulata inibe a expressão das caspases 6 e 9 nas células cancerosas do cólon e fígado (Mondal et al, 2007), enquanto os extratos orgânicos e aquosos de A. squamosa para baixo regulam a expressão de Bcl-2 em células de câncer de mama MCF-7 e células de leucemia K-562, indicando seu efeito como indutores de apoptose (Pardhasaradhi et al., 2005). Além disso, o extrato foliar de A. muricata induz a expressão das caspases 3 e 9 e inibe a proliferação celular, reduzindo o fosfo-ERK e o fosfo-AKT em células MIA PaCa-2 (Yiallouris et al., 2018).
Os AAs também levam à parada do ciclo, o que tem implicações para a proliferação de células tumorais. Os AAs regulam o ciclo celular na transição G1/S através da inibição da expressão da ciclina D1 nas células do carcinoma hepatocelular humano (Qian et al., 2015). Neste contexto, o extrato de A. muricata prende o ciclo celular na fase G1 e diminui o número de células na fase S de forma dependente da concentração, reduzindo a expressão da ciclina D1, uma importante proteína reguladora do ciclo celular (Torres et al., 2012). Um resultado semelhante foi observado para a squamocina, que prende células na fase G1 em células cancerosas da bexiga T24 (Yuan et al., 2006). Apesar da relevância do ciclo celular, poucos estudos abordaram como os AAs afetam esse mecanismo.
Aerobic glycolysis, mecanismo utilizado pelas células tumorais para obter energia na ausência de oxigênio (Figueroa-González et al., 2016; García-Castillo et al., 2017), também é um alvo dos AAs. Várias proteínas e enzimas glicolíticas são upreguladas pelo HIF-1, um importante fator de transcrição envolvido na glicólise aeróbica tumoral, nas células cancerígenas. Curiosamente, o extrato de A. muricata reduziu a expressão de HIF-1α e NF-κB e os níveis do GLUT1 e das enzimas HKII e LDHA nas células cancerosas pancreáticas (Torres et al., 2012). Além disso, o extrato de folhas de A. muricata mostrou efeitos antiproliferativos nas linhas celulares cancerígenas e promoveu a morte celular pela inibição das bombas NKA e SERCA (Yiallouris et al, 2018).
Por outro lado, o gene MDR1 codifica a glicoproteína P da membrana celular, uma proteína chave transportadora que extrudes drogas anticancerígenas do interior das células, limitando assim o seu acúmulo intracelular e diminuindo a sua toxicidade (Figueroa-González et al., 2012). Metabolitos secundários, como flavonóis, ginsenósidos, polifenóis, alcalóides e glicosídeos resinosos, têm mostrado resultados interessantes na modulação do P-gp nas linhas celulares cancerígenas (Phang et al., 1993; Beck et al., 1988; Silva et al., 2001; Jodoin et al., 2002; Zhou et al., 2004; Figueroa-González et al., 2012). Além disso, os AAs podem diminuir a expressão dos genes MDR1 e MRP1 no carcinoma hepatocelular humano resistente a drogas, assim como a expressão da topoisomerase IIα e da glutationa S-transferaseΠ (Qian et al., 2015).
Recentemente, a autofagia tinha gerado interesse como mecanismo de morte celular. A autofagia é um processo catabólico que as células eucarióticas ativam quando sob estresse, como a fome das células ou a presença de patógenos (He e Klionsky, 2009). Durante este processo, a célula recicla proteínas ou organelas não funcionais em um processo de múltiplas etapas envolvendo degradação lisossômica para finalmente recuperar a homeostase celular (Kenific e Debnath, 2015). Como tal, a desregulação do fluxo autofágico pode levar ao cancro, uma vez que a reciclagem de macromoléculas, organelas não funcionais e proteínas fornecem às células cancerosas elevados requisitos metabólicos para a proliferação celular (Kenific e Debnath, 2015; García-Castillo et al., 2017). Neste cenário, a autofagia tornou-se um alvo terapêutico atraente, e os AAs podem ser capazes de inibir este processo. Liu et al. (2012) relataram que o composto AA005 (um análogo de acetogenina) inibiu a produção de ATP, ativou o AMPK e bloqueou o caminho do Complexo mTOR 1 para finalmente induzir a autofagia nas células cancerosas do cólon e para parar o ciclo celular na fase G1. Este composto é uma mímica dos AAs, onde uma unidade de éter etilenoglicol substitui os dois anéis de THF. Esta modalidade química confere uma actividade biológica superior, um exemplo da plasticidade dos AAs a considerar como inspiração para criar moléculas novas e mais poderosas com diferentes alvos farmacológicos.
Atividade de Acetogeninas em Modelos Animais
Os dados relativos à actividade anticancerígena dos AAs e dos extractos de Annona são particularmente promissores uma vez que estes compostos exibiram actividade antitumoral em modelos animais. Estudos in vivo fornecem informações chave sobre o desempenho do medicamento em todo um organismo e permitem avaliar não apenas seu efeito antitumoral, mas também sua toxicidade em diferentes órgãos. Importante, os animais são sujeitos experimentais que permitem realizar acompanhamento clínico, incluindo avaliação de resultados clínicos, progressão e sobrevida livre de doenças e recidiva de doenças.
O extrato de acetato de etila de A. squamosa que é rico em AAs 12,15-cis-squamostatina-A (4) e bullatacina (5) reduziu o crescimento tumoral de tumores hepatocelulares em camundongos a uma taxa inibitória máxima de 69,55% comparada ao controle positivo (ciclofosfamida) (Chen et al, 2012b). Foi sugerido que a configuração cis em um dos componentes poderia ser responsável pela atividade citotóxica do preparo herbal. Além disso, a bullatacina (5) isolada da A. squamosa na dose de 15 μg/kg reduziu efetivamente o crescimento tumoral em ratos portadores de xenografts S180 e HepS em 65,8 e 63,4%, respectivamente. Estes resultados são superiores aos obtidos utilizando concentrações mais elevadas de taxol (40 μg/kg). A bullatacina (5) possui um grupo bis-THF adjacente e três grupos hidróxi, que provavelmente constituem a estrutura bioactiva (Chen et al., 2012a).
O óleo de semente de A. squamosa inibiu 53,54% do crescimento tumoral em ratos com células H22 (Chen et al., 2016) e reduziu a expressão de IL-6, Jak e vários transdutores de sinal fosforilado e activadores da via de transcrição p-Stat3. Também foi relatado que as moieties não saturadas α, β-unsaturated γ-lactone presentes nas AAs são aceitadores da reação de Michael (Ji et al., 2012), que inibem a ativação de Stat3, um alvo terapêutico envolvido na proliferação celular, apoptose, inflamação e angiogênese (Cafferkey e Chau, 2016). O extrato de A. muricata retardou o crescimento tumoral no pâncreas xenogênico (Yiallouris et al.2018), reduzindo a metástase pela diminuição dos níveis da metaloproteinase-9, e promovendo a morte das células cancerosas por necrose (Torres et al., 2012). Em um xenoenxerto de próstata, o extrato de A. muricata enriquecido com flavonóides melhorou a biodisponibilidade e mostrou menor toxicidade do que o extrato enriquecido com AAs (Yang et al., 2015).
Laherradurin (6) e querimolin-2 (7) foram isolados da planta medicinal A. diversifolia e testados in vivo contra células cancerosas do colo do útero e colorretal (Schlie-Guzmán et al., 2009). Ambos os AAs reduziram o tamanho dos tumores de HeLa com valores similares aos da doxorubicina; ambos os compostos também apresentaram atividade antiproliferativa in vitro contra a mesma linha de células cancerígenas. Estes resultados estão de acordo com outros relatos, onde a molécula mais ativa foi relatada como sendo laherradurina (6), que possui moieties de bis-THF adjacentes e uma estrutura de querimolin-2 (7) que contém uma moiety de bis-THF não-adjacente e uma unidade de γ-lactone exibe uma atividade antitumoral reduzida. A Tabela 2 descreve as atividades antitumorais de vários AAs em modelos animais.
Estudos de toxicidade
Experimentos com animais devem incluir protocolos de toxicidade oral aguda para testar produtos químicos e observar sinais de toxicidade; estes minimizam o número de animais necessários, asseguram uma administração correta da dose nos experimentos, e evitam sofrimento (OECD, 2008). Entretanto, até o momento, há pouca informação sobre a toxicidade dos extratos de AAs ou Annona. Por exemplo, o LD50 para o extrato de etanol de A. muricata em camundongos era de 1,67 g/kg, de acordo com Sousa et al. (2010). Arthur et al. (2011) relataram o LD50 (<5 g/kg) do extrato aquoso, registrando que uma dose maior poderia danificar os rins. Também foi observado que o extrato de semente de A. squamosa poderia causar dano hepático (Miao et al., 2016b), e o extrato de A. muricata enriquecido com flavonóides exibiu toxicidade reduzida em um xenoenxerto de próstata (Yang et al., 2015). Cherimolin-2 isolado de A. diversifolia exibiu efeitos tóxicos e morte em xenoenxertos SW480 em doses superiores a 5 mg/kg/dia (Schlie-Guzmán et al., 2009).
Como explicado anteriormente, AAs podem inibir o complexo 1 da cadeia respiratória através do transporte da cadeia de electrões nas mitocôndrias. Os AAs unem e bloqueiam a enzima NADH, que geralmente é superexpressa nas células cancerígenas, inibindo a produção de ATP, levando eventualmente à morte celular. Presumivelmente, tal mecanismo sugere que os AAs são “inofensivos” às células normais; ainda assim, mais estudos devem ser realizados para assegurar a seletividade dessas moléculas.
Conclusão
A quimioterapia não é específica às células cancerígenas; ela causa vários efeitos colaterais indesejáveis como danos aos tecidos e órgãos normais. Contudo, o aspecto mais importante da quimioterapia convencional é que, num número significativo de casos, as células cancerígenas desenvolvem mecanismos de resistência que permitem a progressão tumoral e a metástase.
A busca de novos medicamentos na natureza não é nova. Vários derivados de substâncias naturais são atualmente utilizados para tratar diferentes doenças. Por exemplo, o taxol (paclitaxel) que foi descoberto pelo conhecimento tradicional é considerado o tratamento mais rentável do mercado para o câncer. Curiosamente, o paclitaxel é um medicamento antimitótico que inibe a proliferação celular em culturas celulares mas, em tumores, tem sido documentado para induzir divisões multipolares, o que retrata como uma molécula pode ter diferentes mecanismos de ação, dependendo das condições in vitro ou do paciente. Este alcaloide tem 30 anos de história e ilustra os principais obstáculos do trabalho com produtos naturais, sua limitada disponibilidade biológica e os custos de produção, e também a incrível eficácia matando células cancerígenas.
Acetogeninas são moléculas anticancerígenas versáteis causando a morte de células tumorais por diferentes mecanismos. Elas podem modular a exclusão de medicamentos quimioterápicos das células cancerosas e são fortes indutores de apoptose. A sua flexibilidade bioactiva reflecte-se na sua capacidade de regular o ciclo celular através da paragem das células na fase G1, promovendo a apoptose através da inibição de várias proteínas, e até induzindo a autofagia. Além disso, destacam-se as suas interacções metabólicas, especificamente relacionadas com os factores de transcrição HIF1 e STAT3 e as suas repercussões no consumo de energia, angiogénese, inflamação e metástase. A atividade antitumoral dos AAs in vivo é promissora (bullatacina, laherradurina e querimolina-2 são exemplos). Contudo, os dados pré-clínicos não são suficientes para obter um bom entendimento da farmacodinâmica e cinética dos AAs, e são necessários testes de toxicidade e solubilidade mais agudos para garantir a segurança e a possibilidade de ensaios clínicos com humanos. Além disso, a incorporação de diferentes ligandos (ou seja, anticorpos, vitaminas e peptídeos) ou a preparação de derivados específicos do tumor poderia melhorar a atividade dos AA e produzir medicamentos mais adequados.
Extratos de plantas são quimicamente complexos, e suas propriedades curativas muitas vezes dependem das interações entre os compostos e suas proporções dentro do extrato. Há ainda muito a descobrir sobre os impactos dos AAs no câncer. Este campo oferece a oportunidade de encontrar novas moléculas para o tratamento desta doença complexa. A padronização dos extratos é, portanto, uma alternativa possível ao uso de suplementos herbais, especialmente em plantas onde as atividades farmacológicas se baseiam na combinação de mais de um composto. Esta mini-revisão lista algumas AAs previamente estudadas que apresentam atividade antitumoral e poderiam ter futuro na pesquisa clínica do câncer.
Author Contributions
NJ-H contribuíram para a concepção, redação e discussão do artigo; CP-P contribuiu substancialmente para a discussão e revisão do manuscrito; VC-T preparou todas as figuras e tabelas; MM-V e AG-E contribuíram para a seção química do artigo; AZ-D contribuiu significativamente na discussão da biologia molecular do artigo. Todos os autores discutiram, revisaram e aprovaram a versão final do manuscrito a ser publicado.
Funding
Este trabalho foi apoiado pelo Conselho Nacional de Ciência e Tecnologia (CONACYT), México (subsídio número 285884). VC-T foi financiado pelo CONACYT (bolsa de doutorado número 267787).
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Confirmações
NJ-H agradece CONACYT pelo financiamento do projeto.
Alonso-Castro, A. J., Villarreal, M. L., Salazar-Olivo, L. A., Gómez-Sánchez, M., Domínguez, F., García-Carrancá, A. (2011). Plantas medicinais mexicanas utilizadas para o tratamento do câncer: estudos farmacológicos, fitoquímicos e etnobotânicos. J. Etnopharmacol. 133, 945-972. doi: 10.1016/j.jep.2010.11.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Arthur, F., Woode, E., Terlabi, E., Larbie, C. (2011). Avaliação da toxicidade aguda e subcrónica de Annona muricata (Linn). extracto aquoso em animais. Eur. J. Exp. Biol. 1 (4), 115-124.
Google Scholar
Beck, W. T., Cirtain, M. C., Glover, C. J., Felsted, R. L., Safa, A. R. (1988). Efeitos dos alcalóides indole na resistência a múltiplas drogas e etiquetagem da glicoproteína P por uma afinidade fotográfica análoga da vinblastina. Biochem. Biofísicos. Res. Comun. 153, 959-966. doi: 10.1016/S0006-291X(88)81321-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Brindis, F., González-Trujano, M. E., González-Andrade, M., Aguirre-Hernández, E., Villalobos-Molina, R. (2013). Extrato aquoso de Annona macroprophyllata: um potencial inibidor α-glucosidase. Biomed Res. Int. 443 (2), 495-499. doi: 10.1155/2013/591313
CrossRef Full Text | Google Scholar
Cafferkey, C., Chau, I. (2016). Novos inibidores STAT3 para o tratamento do câncer gástrico. Opinião de especialistas. Investigação. Drogas 25, 1023-1031. doi: 10.1080/13543784.2016.1195807
PubMed Abstract | CrossRef Full Text | Google Scholar
Chávez, D., Mata, R. (1998). Purpurediolin e purpurenina, duas novas acetogeninas bis-tetra-hidrofuranas anonaceas adjacentes das sementes de Annona purpurea. J. Nat. Prod. 61, 580-584. doi: 10.1021/np970410
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Xu, S., Wang, Y., Li, X., Cai, B., et al. (2012a). Atividade antitumoral de acetogeninas anônimas em ratos HepS e S180 xenoenogênicos portadores de ratos. Bioorg. Med. Quimioterápicos. Lett. 22, 2717-2719. doi: 10.1016/j.bmcl.2012.02.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Sh, Xu, Chen, J., Wang, Y., Xu, H., Fan, N., et al. (2012b). Actividade anti-tumoral do extracto de sementes de Annona squamosa contendo compostos de acetogenina anonáceos. J. Etnopharmacol. 142, 462-466. doi: 10.1016/j.jep.2012.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Wang, Y., Xu, S., Li, X. (2012c). Seis acetogeninas anonáceas citotóxicas de sementes de Annona squamosa. Química alimentar. 135, 960-966. doi: 10.1016/j.foodchem.2012.05.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, Y., Shi, Y., Ch, Ma, Wang, X., Li, Y., et al. (2016). Atividade de antitumor do óleo de semente de Annona squamosa. J. Ethnopharmacol. 193, 362-367. doi: 10.1016/j.jep.2016.08.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Da Rocha, A. B., Lopes, R. M., Schwartsmann, G. (2001). Produtos naturais em terapia anticancerígena. Moeda. Opinião. Farmacol. 1, 364-369. doi: 10.1016/S1471-4892(01)00063-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Elisya, Y., Kardono, L. B. S., Simanjuntak, P. (2014). Formulação em comprimidos do extracto de acetato de etilo solúvel de folhas de soursop (Annona muricata L). AJAS 2 (3), 323-329.
Google Scholar
Figueroa-González, G., Jacobo-Herrera, N., Zentella-Dehesa, A., Pereda-Miranda, R. (2012). Reversão ou resistência multi-drogas por glicosídeos de resina de glória matinal em células humanas de câncer de mama. J. Nat. Prod. 75 (1), 93-97. doi: 10.1021/np200864m
PubMed Abstract | CrossRef Full Text | Google Scholar
Figueroa-González, G., García-Castillo, V., Coronel-Hernández, J., López-Urrutida, E., León-Cabrera, S., Arias-Romero, L. E., et al. (2016). Atividade anti-inflamatória e antitumoral de uma terapia tripla para um câncer colorretal relacionado a colites. J. Cancer 7 (12), 1632-1644. doi: 10.7150/jca.13123
PubMed Abstract | CrossRef Full Text | Google Scholar
García-Castillo, V., López-Urrutia, E., Villanueva-Sánchez, O., Ávila-Rodríguez, MÁ, Zentella-Dehesa, A., Cortés-González, C., et al. (2017). Remodelação metabólica em câncer de mama triplo negativo em um modelo murino. J. Cancer 8 (2), 178-189. doi: 10.7150/jca.16387
PubMed Abstract | CrossRef Full Text | Google Scholar
He, C., Klionsky, D. J. (2009). Mecanismos de regulação e vias de sinalização da autofagia. Annu. Rev. Genet. 43, 67-93. doi: 10.1146/annurev-genet-102808-114910
PubMed Abstract | CrossRef Full Text | Google Scholar
Igney, F. H., Krammer, P. H. (2002). Morte e anti-morte: resistência tumoral à apoptose. Nat. Rev. Cancer 2 (4), 277-288. doi: 10.1038/nrc776
PubMed Abstract | CrossRef Full Text | Google Scholar
Jacobo-Herrera, N. J., Jacobo-Herrera, F. E., Zentella-Dehesa, A., Andrade-Cetto, A., Heinrich, M., Pérez-Plasencia, C. (2016). Plantas medicinais utilizadas na medicina tradicional mexicana para o tratamento do câncer colorretal. J. Ethnopharmacol. 179, 391-402. doi: 10.1016/j.jep.2015.12.042
PubMed Abstract | CrossRef Full Text | Google Scholar
Ji, L., Yuan, Y., Luo, L., Chen, Z., Ma, X., Ma, Z., et al. (2012). As Physalinas com atividade anti-inflamatória estão presentes em Physalis alkekengi var. franchetii e podem funcionar como aceitadores da reação de Michael. Steroids 77, 441-447. doi: 10.1016/j.steroids.2011.11.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Jodoin, J., Demeule, M., Béliveau, R. (2002). Inibição da atividade de polifenóis de chá verde por polifenóis multirresistência P-glycoprotein. Biochim. Biófilos. Acta 1542 (1-3), 149-159. doi: 10.1016/S0167-4889(01)00175-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenific, C. M., Debnath, J. (2015). Funções celulares e metabólicas para a autofagia em células cancerígenas. Trends Cell Biol. 25 (1), 37-45. doi: 10.1016/j.tcb.2014.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Ko, Y. M., Wu, T. Y., Wu, Y. C. h., Chang, F.r., Guh, J.Y., Chuang, L. Y. (2011). A anonacina induz a parada de crescimento dependente do ciclo celular e apoptose nas vias relacionadas ao receptor de estrogênio-α nas células MCF-7. J. Ethnopharmacol. 137, 1283-1290. doi: 10.1016/j.jep.2011.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Lima, L. A. R. S., Alves, T. M. A., Zani, C. L., Júnior, P. A. S., Romanha, A. J., Johann, S., et al. (2014). Actividades citotóxicas, antifúngicas, tripanocidas e leishmanicidas in vitro de acetogeninas isoladas de Annona cornifolia A. St.-Hil. (Annonaceae). An. Acad. Sutiã. Cienc. 86 (2), 829-839. doi: 10.1590/0001-3765201420130048
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Cheng, X., Guo, L. X., Ch, Mao, YJ, Chen, Liu, H. X., et al. (2012). Identificação de um mimetic acetogeninas anónimas, AA05, como activador AMPK e indutor de autofagia em células cancerosas do cólon. PLoS One 7 (10), e47049-e-47049. doi: 10.1371/journal.pone.0047049
CrossRef Full Text | Google Scholar
Mangal, M., Khan, M. I., Agarwal, S. M. (2016). Acetogeninas como potenciais agentes anticancerígenos. Agentes Anticancerígenos Med. Chem. 16, 138-159. doi: 10.2174/1871520615666150629101827
CrossRef Full Text | Google Scholar
Miao, Y. J., Shi, Y. Y., Xu, X. F., Chen, Y., Chen, J. W., Li, X. (2016a). Três acetogeninas anonáceas citotóxicas das sementes de Annona squamosa. Fitoquímica. Lett. 16, 92-96. doi: 10.1016/j.phytol.2016.03.006
CrossRef Full Text | Google Scholar
Miao, Y. J., Shi, Y. Y., Li, F. Q., Shan, C. h. X., Chen, Y., Chen, J. W., et al. (2016b). Estudo metabólico sobre a toxicidade de Annona squamosa por espectrometria de massa de alta definição por cromatografia líquida de ultraperformace, em conjunto com abordagem de reconhecimento de padrões e análise de vias metabólicas. J. Etnopharmacol. 184, 187-195. doi: 10.1016/j.jep.2016.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Fadaeinasab, M., Nikzad, S., Mohan, G., Ali, H. M., Kadir, H. A. (2015a). Annona muricata (Annonaceae): uma revisão do seu uso tradicional, acetogeninas isoladas e actividades biológicas. Int. J. Mol. Sci. 16, 15625-15658. doi: 10.3390/ijms160715625
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Rouhollahi, E., Karimian, H., Fadaeinasab, M., Firoozinia, M., Abdulla, M. A., et al. (2015b). O efeito quimiopotencial das folhas de Annona muricata contra focos de cripta aberrantes do cólon induzidos por azoximetano em ratos e o efeito apoptose da acetogenina annomuricina E em células HT-29: uma abordagem guiada pelo bioensaio. PLoS One 10 (4), e0122288. doi: 10.1371/journal.pone.0122288
PubMed Abstract | CrossRef Full Text | Google Scholar
Mondal, S. K., Mondal, N. B., Mazumder, U. K. (2007). Efeito caspase in vitro citotóxico e humano recombinante das folhas de Annona reticulata. Índio J. Pharmacol. 39, 253-254. doi: 10.4103/0253-7613.37279
CrossRef Full Text | Google Scholar
Newman, D. J., Cragg, G. M. (2016). Produtos Naturais como fontes de novas drogas de 1981 a 2014. J. Nat. Prod. 79 (3), 629-661. doi: 10.1021/acs.jnatprod.5b01055
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobili, S., Lippi, D., Witort, E., Donnini, M., Bausi, L., Mini, E., et al. (2009). Compostos naturais para o tratamento e prevenção do cancro. Pharmacol. Res. 59, 365-378. doi: 10.1016/j.phrs.2009.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
OECD (2008). “Texto no. 425: Toxicidade oral aguda: procedimento para cima e para baixo” na OECD Guildelines for the testing of chemicals, Secção 4. OECDiLibrary. https://www.oecd-ilibrary.org/environment/test-no-425-acute-oral-toxicity-up-and-down-procedure_9789264071049_en
Google Scholar
Okada, H., Mak, T. W. (2004). Caminhos da morte apoptótica e não apoptótica em células tumorais. Nat. Rev. Cancer 4 (8), 592-603. doi: 10.1038/nrc1412
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardhasaradhi, B. V., Reddy, M., Ali, A. M., Kumari, A. L., Khar, A. (2005). Efeitos citotóxicos diferenciais dos extratos de sementes de Annona squamosa nas linhas de células tumorais humanas: papel das espécies reativas de oxigênio e do glutatião. J. Biosci. 30, 237-244. doi: 10.1007/BF02703704
PubMed Abstract | CrossRef Full Text | Google Scholar
Phang, J. M., Poore, M., Lopaczynska, J., Yeh, G. C. (1993). Flavonol-estimula efluxo de 7,12-dimetilbenz(a)antraceno em células multirresistentes ao câncer de mama. Cancer Res. 53, 5977-5981.
PubMed Abstract | Google Scholar
Qian, J. Q., Sun, P., Pan, Z. Y., Fang, Z. Z. (2015). As acetogeninas anonáceas revertem a resistência às drogas do carcinoma hepatocelular humano BEL-7402/5-FU e das linhas celulares HepG2/ADM. Int. J. Clin. Exp. Pathol. 8 (9), 11934-11944.
PubMed Abstract | Google Scholar
Raynaud, S., Némati, F., Miccoli, L., Michel, P., Poupon, M. F., Fourneau, C., et al. (1999). Antitumoral effects of squamocin on parental and multidrug resistant MCF7 (human breast adenocarcinoma) cell lines. Life Sci. 65 (5), 525-533. doi: 10.1016/S0024-3205(99)00273-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Savithramma, N., Rao, M. L., Suhrulatha, D. (2011). Triagem de plantas medicinais para metabólitos secundários. MEJSR 8 (3), 579-584.
Google Scholar
Schlie-Guzmán, M. A., García-Carrancá, A., González-Esquinca, A. R. (2009). Atividade antiproliferativa in vitro e in vivo de laherradurin e querimolin-2 de Annona diversifolia Saff. Fitoterápico. Res. 23, 1128-1133. doi: 10.1002/ptr.2760
PubMed Abstract | CrossRef Full Text | Google Scholar
Silva, G. L., Cui, B., Chávez, D., You, M., Hee-Byung, C., Rasoanaivo, P., et al. (2001). Modulação do fenótipo multirresistência por novos ésteres aromáticos alcalóides tropanóides de Erythroxylum pervillei. J. Nat. Prod. 64 (12), 1514-1520. doi: 10.1021/np010295+
PubMed Abstract | CrossRef Full Text | Google Scholar
Sousa, O. V., Vieira, G. D., Pinho, JJRGd, Yamamoto, C. H., Alves, M. S. (2010). Atividades antinociceptivas e antiinflamatórias do extrato de etanol de folhas de Annona muricata L. em modelos animais. Int. J. Mol. Sci. 11 (5), 2067-2078. doi: 10.3390/ijms11052067
PubMed Abstract | CrossRef Full Text | Google Scholar
Sultana, S., Asif, H. M., Nazar, H. M. I., Akhtar, N., Rehman, J. U., Rehman, R. U. (2014). Plantas medicinais que combatem o cancro – uma abordagem anticancerígena verde. Pac. Asiático. J. Cancer P 15 (11), 4385-4394. doi: 10.7314/APJCP.2014.15.11.4385
CrossRef Full Text | Google Scholar
Tantithanaporn, S., Wattanapiromsakul, C., Itharat, A., Keawpradub, N. (2011). Atividade citotóxica de acetogeninas e lactonas de styryl isoladas de Goniothalamus undulatus Ridl. extratos radiculares contra uma linha de células cancerígenas do pulmão (COR-L23). Phytomedicine 18, 486-490. doi: 10.1016/j.phymed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Tormo, J. R., Gallardo, T., Aragón, R., Cortes, D., Estornell, E. (1999). Interações específicas das acetogeninas monotetra-hidrofurânicas anónimas como inibidores do complexo mitocondrial I. Quimiocondrial I. Biol. Interagir. 122, 171-183. doi: 10.1016/S0009-2797(99)00120-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Torres, M. P., Rachagani, S., Purohit, V., Pandey, P., Joshi, S., Moore, E. D., et al. (2012). Graviola: uma nova e promissora droga de origem natural que inibe a tumorigenicidade e metástase das células cancerosas do pâncreas in vitro e in vivo através da alteração do metabolismo celular. Cancer Lett. 323 (1), 29-40. doi: 10.1016/j.canlet.2012.03.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, L. Q., Min, B. S., Li, Y., Nakamura, N., Qin, G. W., Li, C. J., et al. (2002). Acetogeninas de Annonaceous das folhas de Annona montana. Bioorg. Med. Chem. 10, 561-565. doi: 10.1016/S0968-0896(01)00303-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Gundala, R., Mukkavilli, R., Vangala, S., Reid, M. D., Aneja, R. (2015). Interações sinergéticas entre flavonóides e acetogeninas em folhas de Graviola (Annona muricata) conferem proteção contra o câncer de próstata. Carcinogénese 36 (6), 656-665. doi: 10.1093/carcin/bgv046
PubMed Abstract | CrossRef Full Text | Google Scholar
Yiallouris, A., Patrikios, I., Johnson, E. O., Sereti, E., Dimas, K., De Ford, C., et al. (2018). Annonacin promove a morte selectiva de células cancerosas através de vias dependentes da NKA e da SERCA. Morte Célula Dis. 9 (764), 13. doi: 10.1038/s41419-018-0772-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, F., Bai, G., Chen, Y., Miao, Y., Chen, J., Li, X. (2015). Relações estrutura-actividade de diversos ACGs contra o cancro do pulmão humano multirresistente linha de células A549/Taxol. Bioorg. Med. Chem. Lett. 25, 787-790. doi: 10.1016/j.bmcl.2014.12.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S. S., Chang, H. L., Chen, H. W., Yeh, Y. T., Kao, Y. H., Lin, K. H., et al. (2003). Annonacin, um acetogenina mono-tetrahidrofurano, prende células cancerígenas na fase G1 en causa citotoxicidade em uma Bax. E caminho relacionado com a caspase-3. Life Sci. 72, 2853-2861. doi: 10.1016/S0024-3205(03)00190-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S. S., Chang, H. L., Chen, H. W., Kuo, F. c. h., Liaw, C. h. C. h., Su, J. H., et al. (2006). Selective cytotoxicity of squamocin on T24 bladder cancer cells at the S-phase via a Bax-, Bad- and caspase-3 related pathways. Life Sci. 78, 869-874. doi: 10.1016/j.lfs.2005.05.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, L., Wu, F. E., Oberlies, N. H., McLaughlin, J. L., Sastrodihajo, S. (1996). Cinco novas acetogeninas de anel monotetra-hidrofurano das folhas de Annona muricata. J. Nat. Prod. 59, 1035-1042. doi: 10.1021/np960447e
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, S., Lim, L. Y., Chowbay, B. (2004). Modulação herbal de P-glycoprotein. Metab. Rev. 36 (1), 57-104. doi: 10.1081/DMR-120028427
PubMed Abstract | CrossRef Full Text | Google Scholar