- Introduction
- Materiais e Métodos
- População do Estudo
- Variáveis de estudo
- Resultados
- Distribuição do grupo sanguíneo AB0/Rh em pacientes com PCa
- Sem diferenças significativas nas características clínico-patológicas entre os pacientes PCa De acordo com os grupos sanguíneos AB0/Rh
- Não há Valor Prognóstico Significativo do Grupo Sanguíneo para Sobrevivência Livre de BCR após RP
- Discussão
- Consentimento Informado
- Declaração Ética
- Contribuições dos autores
- Conflict of Interest Statement
Introduction
Prostate cancer (PCa) is the most common malignancy in Western countries and the second leading cause of cancer-related deaths in mascules (1). Os fatores de risco mais reconhecidos para o desenvolvimento da PCa são a idade crescente, a origem étnica e a história familiar (2). A predisposição familiar sugere um componente genético herdado para a doença (3), mas representa apenas uma minoria (5-10%) dos casos de PCa. Como consequência, os fatores ambientais e genéticos predisponentes para a maioria dos pacientes ainda são desconhecidos (4, 5). O tipo sanguíneo AB0 é uma característica hereditária que tem sido associada à incidência bem como ao prognóstico de várias neoplasias malignas (6-8). Vários mecanismos plausíveis, incluindo inflamação, vigilância imunológica de células malignas, adesão intercelular e sinalização de membrana foram propostos para explicar a associação observada entre grupos sanguíneos AB0 e risco de câncer.
AB0 antígenos do grupo sanguíneo (ABH) são glicoproteínas expressas na superfície dos glóbulos vermelhos. Os antígenos fenotípicos A e B são carboidratos terminais sintetizados pela adição de açúcares únicos catalisados por uma série de glicosiltransferases específicas. O fenótipo 0 é caracterizado pela ausência de glicosiltransferases A e B, de modo que apenas uma espinha dorsal de proteína, o antígeno H, está presente. Os antígenos dos glóbulos vermelhos têm várias funções, incluindo integridade estrutural da membrana, transporte das moléculas através das membranas e aderência (9). Juntamente com sua expressão nos glóbulos vermelhos, os antígenos ABH também são expressos em uma variedade de células epiteliais, incluindo urotelium, mucosa gastrointestinal e pulmões. Vários estudos demonstraram mudanças no padrão de expressão do ABH nas células cancerosas por grau tumoral e progressão da doença, sugerindo uma possível associação entre o grupo sanguíneo AB0 e o risco de algumas malignidades epiteliais (8, 10). Estudos recentes demonstraram que indivíduos com grupo sanguíneo A, AB ou B tinham uma incidência aumentada de câncer no pâncreas em comparação com aqueles com grupo sanguíneo 0, enquanto que o maior risco entre os que tinham grupo sanguíneo B (8). Da mesma forma, foi relatado que o serótipo sanguíneo A estava associado a maior risco de câncer gástrico, de mama e de ovário (11). Por outro lado, o grupo sanguíneo 0 foi correlacionado com as maiores taxas de recorrência e progressão após a ressecção transuretral da bexiga e, portanto, associado a pior prognóstico em pacientes com carcinoma urotelial vesical invasivo não-músculo (6).
Por isso, o objetivo do presente estudo foi acrescentar mais informações ao debate em andamento, analisando a correlação do grupo sanguíneo AB0/Rh e sua distribuição dentro dos pacientes com PCa, patologia tumoral, recorrência e mortalidade em pacientes com PCa localizada submetidos à RP, utilizando um grande conjunto de dados de um único centro de 3.574 pacientes.
Materiais e Métodos
População do Estudo
O estudo foi aprovado pelo conselho de revisão institucional. Um total de 3.582 pacientes com PCa clinicamente localizados que foram submetidos a RP em nossa instituição entre 2009 e 2010 foram selecionados para inclusão no estudo. Foram excluídos aqueles com conjuntos de dados incompletos e falta de acompanhamento (n = 8), deixando 3.574 pacientes disponíveis para análise.
A prostatectomia rádica foi realizada por via aberta retropúbica (n = 3.220) ou por via laparoscópica robótica (n = 354), conforme descrito anteriormente (15). A dissecção dos gânglios linfáticos foi realizada em pacientes D’Amico de risco intermediário e alto risco, de acordo com as diretrizes da Associação Européia de Urologia (EAU) para PCa (16). As peças cirúrgicas foram processadas de acordo com procedimentos histopatológicos padrão e avaliadas por uropatologistas experientes em um centro de alto volume (>2.000 peças de prostatectomia por ano). Os tumores foram estadiados de acordo com o sistema de estadiamento TNM do American Joint Committee on Cancer 2007 e a classificação histopatológica foi atribuída de acordo com o sistema de Gleason (17).
Todos os participantes foram submetidos a testes sorológicos antes da RP. A confirmação laboratorial do grupo sanguíneo AB0 e Rh foi obtida do Departamento de Medicina Transfusional, Hospital Universitário Hamburg-Eppendorf. A distribuição de referência AB0 da população alemã foi usada como controle (18).
Variáveis de estudo
Variáveis de estudo incluíram grupo sanguíneo AB0/Rh, idade, antígeno pré-operatório específico da próstata (PSA), volume da próstata (ultrassom transretal), escore de Gleason (espécime), estágio pT, estado pN, margem cirúrgica, BCR e mortalidade após RP. O acompanhamento dos pacientes consistiu em testes de PSA a cada 3-6 meses durante os primeiros 2 anos após a RP, BCR foi definido como nível de PSA ≥0.2 ng/ml.
A relação entre o grupo sanguíneo AB0 e as variáveis clinicopatológicas foi avaliada usando testes de qui-quadrado e testes t. Na análise multivariável de regressão de Cox (log-rank tests), o impacto do grupo sanguíneo, do PSA pré-operatório, do escore de Gleason, do estágio pT, do estado pN e da margem cirúrgica na sobrevida livre de BCR foram avaliados a fim de avaliar os valores prognósticos de sobrevida. A probabilidade de sobrevida livre de BCR foi comparada nos grupos 0, A, B e AB utilizando a análise de Kaplan-Meier e o teste log-rank.
Todos os testes foram bicaudais e os valores de p <0,05 foram considerados estatisticamente significativos. As análises estatísticas foram realizadas com o software JMP v9.0.2 (SAS Institute, Inc., SAS Institute, Inc.), Cary, NC, EUA) e R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Resultados
Um total de 3.574 pacientes com PCa clinicamente localizada foram elegíveis para análises finais, a mediana da idade na cirurgia foi de 65 anos (variação: 38-80) e o seguimento mediano foi de 36,9 meses (Tabela 1).

Tábua 1. Associação do grupo sanguíneo AB0 e fator Rhesus com características clinicopatológicas de 3.574 pacientes tratados com prostatectomia radical.
Distribuição do grupo sanguíneo AB0/Rh em pacientes com PCa
A distribuição do grupo sanguíneo AB0 entre pacientes com PCa antes da RP foi a seguinte: 0 em 1.350 (38%), A em 1.605 (45%), B em 445 (12%), e AB em 174 (5%) pacientes, 83% dos pacientes eram Rh positivos (Tabela 1). A distribuição de referência para a população alemã é dada como (18): 0 em 41%; A em 43%; B em 11%; AB em 5%; Rhesus positivo: 85%. As distribuições gerais dos grupos sanguíneos AB0 e Rh na coorte do estudo foram equivalentes à distribuição observada na população masculina alemã.
Sem diferenças significativas nas características clínico-patológicas entre os pacientes PCa De acordo com os grupos sanguíneos AB0/Rh
A maioria dos pacientes tinha PCa clinicamente localizada com perfil de risco intermediário. O escore de Gleason mais relatado foi 3 + 4 (66,9%) e 63,3% dos pacientes tinham níveis de PSA pré-operatório dentro da faixa de 4-10 ng/ml. Tumores de pT2 foram detectados em 68,7% e margens negativas foram alcançadas em 81,3% dos pacientes. O volume médio da próstata foi de 40 ml e o envolvimento dos gânglios linfáticos foi diagnosticado em 224 (6,3%) pacientes (Tabela 1). Não houve diferenças significativas nas características clinicopatológicas entre os pacientes com diferentes grupos sanguíneos AB0. Percentuais ligeiramente aumentados de estágio avançado do tumor (≥pT3b) foram encontrados em pacientes com grupo sanguíneo AB em comparação aos grupos sanguíneos 0, A e B (16,1, 12,6, 9,9 e 13,7%, respectivamente, p = 0,033). A população de pacientes com AB também apresentou uma razão moderadamente aumentada de fator Rh negativo (21,8%) em comparação com os outros grupos sanguíneos (16,9%, p = 0,01) (Tabela 1).
Não há Valor Prognóstico Significativo do Grupo Sanguíneo para Sobrevivência Livre de BCR após RP
De acordo com a análise de regressão de cox multivariável, PSA pré-operatório, escore de Gleason, estágio de pT, pN e margem cirúrgica significativamente e independentemente correlacionada com sobrevida livre de BCR (todos p < 0,05) (Tabela 2). Entretanto, não pudemos observar nenhum impacto do grupo sanguíneo AB0 nas taxas de BCR (Figura 1). Avaliamos ainda o valor prognóstico do grupo sanguíneo 0 em relação aos grupos sanguíneos não-0, bem como dentro dos grupos sanguíneos alternativos A/B/AB com resultados insignificantes (Tabela 2). Mesmo que se realizassem sub-análises apenas com pacientes com margem positiva ou negativa, a influência do AB0/Rh sobre a BCR permaneceu insignificante (Figuras 2A,B). Além disso, o status do fator Rhesus dos pacientes também não teve impacto na sobrevida livre de BCR (p = 0,74).
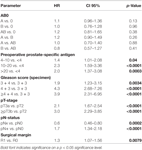
Tábua 2. Modelos de regressão de cox multivariável de AB0 e fatores prognósticos padrão para sobrevivência livre de recorrência bioquímica.
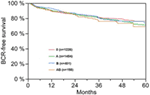
Figura 1. Sobrevida livre de recorrência bioquímica (BCR) após prostatectomia radical estratificada por grupos sanguíneos AB0 (p = 0,572).
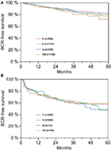
Figura 2. (A,B) Sobrevida livre de recorrência bioquímica (BCR) após prostatectomia radical estratificada por grupos sanguíneos AB0 em pacientes com margem cirúrgica negativa e positiva.
Discussão
Associações possíveis entre o grupo sanguíneo AB0 e o risco de algumas malignidades epiteliais, incluindo câncer pancreático, colorretal e gástrico têm sido relatadas com freqüência (19, 20). Além disso, os grupos sanguíneos AB0/Rh estão disponíveis para a maioria dos pacientes antes da intervenção cirúrgica, sugerido como um marcador adjunto ideal sem qualquer etapa adicional de processamento laboratorial.
Décadas atrás, estudos imunohistoquímicos indicaram que células PCa derivadas de pacientes mostram padrões diferentes de expressão de ABH do que células normais/benignas da próstata (21). Como tanto o grupo sanguíneo AB0 quanto sua expressão antigênica no tecido têm sido relatados como associados à incidência, progressão da doença e desfecho em várias neoplasias malignas (8, 22, 23), tal expressão alterada do antígeno ABH no tecido prostático sugeriu uma possível influência do grupo sanguíneo na transformação maligna das células prostáticas.
Um estudo recente publicado por Markt e colegas (14) analisou a relação entre o tipo sanguíneo AB0 e o risco de abrigar PCa agressivo. Os autores analisaram um conjunto de dados de 2.774 pacientes com PCa agressiva e 4.443 pacientes sem PCa como controles. Usando esses dados, não foi possível mostrar uma correlação significativa entre o tipo sanguíneo AB0 ou “dose” de alelos A ou B e o risco de abrigar PCa agressiva. Embora os autores também tenham relatado mortalidade específica do câncer e mortalidade geral estratificada por grupos sanguíneos, o estudo não incluiu informações sobre o tratamento da PCa. Além disso, foram incluídos apenas pacientes com tumores agressivos que poderiam mascarar o efeito potencial de diferentes grupos sanguíneos.
Estes resultados estão de acordo com um estudo realizado por Kvist e colegas, que demonstrou não haver correlação entre o tipo sanguíneo AB0 e a sobrevida de pacientes com PCa administrada com espera vigilante. Este estudo foi limitado principalmente pelo pequeno número de casos (n = 279) (12). Curiosamente, o único estudo com foco em pacientes após RP incluindo 555 pacientes japoneses recentemente relatou que o grupo sanguíneo 0 estava significativamente associado a uma diminuição do risco de BCR após RP em análise multivariável, mas não univariável (13). Na subanálise de pacientes com margem cirúrgica negativa, a taxa de 5 anos sem BCR no grupo sanguíneo 0 foi significativamente maior que a do grupo A (91,2 vs. 71,0%; p = 0,026). Neste estudo de coorte, 46,3% dos pacientes tiveram margem positiva, apesar de um estágio clínico de T1c em 74,2% dos pacientes. O estágio patológico (pT) não foi mencionado.
Nossa coorte retrospectiva de 3.574 pacientes com PCa clinicamente localizada é a maior coorte sendo analisada até o momento para determinar um possível impacto dos grupos sanguíneos AB0 e Rh sobre as características e o resultado do tumor após a RP. No presente estudo, a maioria dos pacientes apresentava tumores pT2 (68,7%) e 18,6% tinham status de margem positiva. Usando esses dados, não pudemos mostrar qualquer impacto significativo dos grupos sanguíneos AB0/Rh nas características clinicopatológicas (PSA pré-operatório, escore de Gleason, volume da próstata, estágio de pT, estado pN e margem cirúrgica) e sobrevida livre de BCR após a RP curativa. Além disso, ao realizar uma subanálise apenas com pacientes com margem positiva ou negativa, a influência do AB0/Rh sobre o BCR permaneceu insignificante. Portanto, não foi possível reproduzir os resultados do estudo japonês (13). Ao contrário de outras neoplasias malignas, como câncer de pâncreas ou de bexiga, o grupo sanguíneo AB0/Rh não apresentou valor prognóstico no PCa.
Existem várias limitações importantes ao nosso estudo. Antes de mais nada, as limitações inerentes às análises retrospectivas e a falta de um grupo controle. Além disso, nossa coorte de estudo contém predominantemente PCa localizada com perfil de risco baixo a intermediário (escore de Gleason 3 + 4 em 66,9%, PSA pré-operatório de 4-10 ng/ml em 63,3%, pT2 em 68,7% e margens negativas em 81,3% de pacientes) permitindo a pré-seleção de pacientes com prognóstico favorável. Além disso, a distribuição geral do AB está em contraste com os outros grupos sanguíneos – geralmente pouco abundante (4,9%). Algumas observações, como a razão moderadamente aumentada do fator Rh negativo (21,8%) em pacientes com AB em comparação com os outros grupos sanguíneos (16,9%, p = 0,01), poderiam ser possivelmente impulsionadas devido à raridade do tipo AB negativo Rh, o que impede uma detecção estatisticamente significativa de uma correlação dentro deste subgrupo. Finalmente, faltavam informações sobre o genótipo do respectivo grupo sanguíneo.
Além das características acima mencionadas, preocupações ambientais, geográficas e raciais nunca podem ser negligenciadas ao discutir correlações do grupo sanguíneo AB0 com câncer. As diferenças raciais e étnicas nos grupos sanguíneos, bem como na PCa, são bem conhecidas (24, 25). Na Europa, onde a PCa é a malignidade mais comum e a segunda principal causa de morte relacionada ao câncer nos homens (1), os tipos de sangue mais frequentes são A e 0, aumentando para o alelo B do Ocidente para o Oriente. Em contraste, os países asiáticos com menor incidência e baixo grau de PCa são caracterizados por uma alta ocorrência de tipos B e baixa freqüência relativa de 0, assim como uma população menor com fator Rh negativo (26). A este respeito, nossos resultados diferem do estudo atual em pacientes japoneses com margem positiva relativamente alta e BCR após RP curativa (13).
Mecanismos transversais foram propostos para explicar como o grupo sanguíneo influencia a incidência e a progressão do câncer; entretanto, ainda não estão claros. Em caso de câncer de bexiga, foi sugerida uma aberração cromossômica, pois o gene AB0 está localizado no cromossomo 9q34, uma área frequentemente alterada no câncer de bexiga (27). Como o gene AB0 na verdade codifica as glicosiltransferases, que catalisam a transferência de açúcares para o antígeno H (0), a ocorrência de câncer de bexiga está potencialmente correlacionada com o grupo sanguíneo 0. Ao contrário disso, tem sido relatado que indivíduos com grupos sanguíneos não 0 (A, AB e B) têm um risco elevado de desenvolver câncer gástrico e indicam um papel específico do grupo sanguíneo para o câncer.
Cando a PCa, há vários esforços em andamento para elucidar o papel do grupo sanguíneo na sobrevivência após a terapia. Já foi relatado que pacientes com tipo sanguíneo não 0 deveriam ter aumentado o risco de tromboembolismo venoso após a RP, o que poderia ter influência no resultado (28). Mesmo um estudo recentemente publicado demonstrou que anticorpos séricos para o grupo sanguíneo A predizem a sobrevida do PROSTVAC-VF (uma vacina terapêutica contra o câncer baseada em poxvírus em ensaios clínicos de fase III para o tratamento da PCa avançada) e devem ser considerados como um novo biomarcador potencialmente preditivo para o PROSTVAC-VF (29). Embora não tenhamos observado nenhuma associação clara entre o grupo sanguíneo AB0/Rh e a patologia e resultado do tumor em nosso estudo, tais evidências ainda sugerem um papel preditivo do grupo sanguíneo na epidemiologia e resultado clínico da PCa, especialmente em vista da resposta terapêutica.
O presente estudo com 3.574 pacientes é o maior até agora analisando o impacto dos grupos sanguíneos AB0 ou Rh na patologia e desfecho após RP e acrescenta importantes conhecimentos à literatura.
Em conclusão, nossos dados não sugerem associação relevante do grupo sanguíneo AB0/Rhesus com características clinicopatológicas adversas do tumor ou desfecho oncológico após cirurgia em contraste com várias outras neoplasias malignas. Entretanto, outras pesquisas são indicadas para avaliar uma possível associação entre genótipo do grupo sanguíneo ou sua expressão antigênica no tecido PCa e prognóstico dentro de diferentes grupos terapêuticos, incluindo PCa de alto grau ou PCa avançada, que não foram suficientemente refletidos em nosso grupo de estudo.
Consentimento Informado
Foi obtido consentimento informado de todos os participantes individuais incluídos no estudo.
Declaração Ética
Todos os procedimentos realizados em estudos envolvendo participantes humanos estavam de acordo com os padrões éticos do comitê de pesquisa institucional e/ou nacional e com a declaração de Helsinque de 1964 e suas emendas posteriores ou padrões éticos comparáveis.
Contribuições dos autores
SO, DT e TS: contribuições substanciais para a concepção ou desenho do trabalho, elaboração do trabalho, aprovação final da versão a ser publicada. PM: contribuições substanciais para a concepção ou desenho do trabalho, elaboração do trabalho, aprovação final da versão a ser publicada. CF: aquisição, análise ou interpretação de dados para a obra, revisão crítica de conteúdo intelectual importante, aprovação final da versão a ser publicada. PT: aquisição, análise ou interpretação de dados para a obra, revisão crítica de conteúdo intelectual importante, aprovação final da versão a ser publicada. SP: aquisição, análise ou interpretação de dados para a obra, revisão crítica de conteúdo intelectual importante, aprovação final da versão a ser publicada. JLH, JH e MG: aquisição, análise ou interpretação de dados para a obra, revisão crítica para conteúdo intelectual importante, aprovação final da versão a ser publicada. Todos os autores concordaram em ser responsáveis por todos os aspectos do trabalho, assegurando que questões relacionadas com a precisão ou integridade de qualquer parte do trabalho sejam adequadamente investigadas e resolvidas.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
O editor de tratamento declarou uma afiliação compartilhada, embora nenhuma outra colaboração, com vários dos autores (CF, SP, JH e DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Estatísticas de câncer, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Factores de risco para o cancro da próstata. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Genetic etiologia do câncer de próstata hereditário. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Reported family history of cancer in the prostate, lung, colorectal, and ovarian cancer screening trial. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Factores ambientais e hereditários na causa do cancro – análises de coortes de gémeos da Suécia, Dinamarca e Finlândia. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impact of ABO blood type on outcomes in patients with primary nonmuscle invasive bladder cancer. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. O gene que codifica o antígeno do grupo sanguíneo I: revisão de um I para um olho. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. A expressão dos antígenos dos grupos sanguíneos A, B e H no tecido do carcinoma correlaciona-se com um mau prognóstico para pacientes com câncer colorretal. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO grupo sanguíneo e incidência de câncer epitelial de ovário. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Variáveis prognósticas em pacientes com câncer de próstata: influência do grupo sanguíneo ABO (H), o sistema Rhesus, idade, diferenciação, estágio do tumor e metástases. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associações entre grupos sanguíneos ABO e recidiva bioquímica após prostatectomia radical. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO alelos do grupo sanguíneo e risco de câncer de próstata: resultados do consórcio de coorte de câncer de mama e próstata (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. O exame de secção congelada da estrutura neurovascular (NeuroSAFE) aumenta a frequência de reparo nervoso e reduz as margens cirúrgicas positivas na prostatectomia radical laparoscópica aberta e assistida por robô: experiência após 11.069 pacientes consecutivos. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Guidelines on Prostate Cancer 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Predição do prognóstico do adenocarcinoma prostático através da combinação de graduação histológica e estadiamento clínico. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. O grupo sanguíneo determina a incidência de câncer pancreático na Alemanha. Front Physiol (2013) 4:118. doi:10.3389/fys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO grupos sanguíneos e câncer. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. O sistema de grupos sanguíneos ABO e Lewis. Imuno-química, genética e relação com a doença humana. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Detecção de antígenos de grupos sanguíneos em secções congeladas do epitélio prostático. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Expressão dos antígenos relacionados com ABH/Lewis como fatores prognósticos em pacientes com câncer de mama. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. A transcrição do gene ABO do grupo sanguíneo é down-regulated nos tumores da bexiga humana e nas linhas celulares uroteliais estimuladas pelo crescimento. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Estudos comparativos do câncer de próstata no Japão versus os Estados Unidos. Uma revisão. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Padrões baseados em modelos de mortalidade por câncer de próstata em todo o mundo. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. ABO e Rh(D) fenótipo frequências de diferentes grupos raciais/étnicos nos Estados Unidos. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Caracterização genotípica e fenotípica do grupo histo-sangue ABO(H) em tumores primários da bexiga. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Câncer de próstata: tipo sanguíneo não-O é fator de risco de TEV após prostatectomia radical. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Texto Completo | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Anticorpos séricos para o grupo sanguíneo A prevêem a sobrevivência no PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar