SONAL DESAI, ARCHITA PATEL E S. Y. GABHE*
C. U. Shah College of Pharmacy, S. N. D. T. Women’s University, Sir Vithaldas Vidya Vihar, Juhu Tara Road, Santacruz (W), Mumbai – 400 049, India
Autor correspondente: S. Y. GABHE E-mail:
| Data de Aceitação | 16-Jan-2011 |
| Data de Revisão | 26-Out-2010 |
| Data de Recebimento | 9-Abr-2009 |
DOI: 10.4103/0250-474X.89762
Abstract
Cromatografia líquida simples de fase reversa isocrática de alto rendimento foi utilizada para separar três impurezas presentes na amostra de 8-cloroteofilina. A LC-MS foi utilizada para a caracterização das impurezas. Com base em dados espectrais de massa, as estruturas dessas impurezas foram caracterizadas como 3,7-di-hidro-1,3-dimetil-1H-purina-2,6-diona (impureza I), 3,7-di-hidro-1,3,7-trimetil-1H-purina-2,6-diona (impureza II) e isômero de 8-cloro- 1,3-dimetil-2,6(3H,1H)-purina-iona (impureza III).
Palavras-chave
8-Cloroteofilina, impureza, LC-MS, HPLC de fase reversa, teofilina
Introdução
A indústria de medicamentos a granel forma a base de todas as indústrias farmacêuticas, pois é a fonte de ingredientes farmacêuticos ativos (APIs) de qualidade especificada. O maior desafio para as indústrias de medicamentos a granel é produzir o medicamento final de qualidade e pureza necessárias, economicamente. A pureza dos IFAs depende de vários fatores, tais como matérias-primas, seus métodos de fabricação e tipo de cristalização ou processo de purificação. No entanto, é quase impossível obter materiais absolutamente puros, uma vez que as impurezas são incorporadas a eles durante a fabricação, purificação ou armazenamento. Uma impureza é qualquer componente de uma substância química (excluindo a água) que não seja uma entidade química definida como substância farmacêutica. Para a substância química produzida por síntese química, a ICH classifica as impurezas em três categorias, tais como impurezas orgânicas, impurezas inorgânicas e solventes residuais. As impurezas presentes na substância podem ser tóxicas, podem alterar as propriedades físicas ou químicas da substância, tornando-a inutilizável medicinalmente. As impurezas podem diminuir a vida útil do produto e podem causar dificuldades na formulação. Portanto, não só o controle das impurezas, mas também a qualificação das impurezas é uma questão crítica para as indústrias de medicamentos a granel.
Antihistaminas como o dimenidrinato e o teoclato de promethazina são drogas amplamente utilizadas no tratamento do enjôo do movimento. 8-Cloroteofilina, quimicamente 8-cloro-1,3-dimetil-2,6(1H, 3H)- purinediona, é um intermediário que é usado na preparação da forma salina destes fármacos. É essencial para garantir a pureza e segurança do dimenidrinato e do teoclato de prometazina. Para isso, a 8-cloroteofilina deve ser obtida com a maior pureza e com um perfil de impureza conhecido.
De um levantamento bibliográfico, Wadke et al. estudaram as interações da 9-metilisoalloxazina e da 3,9-dimetilisoalloxazina com a 8-cloroteofilina. A 8-cloroteofilina foi utilizada como padrão interno para determinação da taxa pelo método HPLC. Também foi determinada potenciometricamente. A determinação simultânea do cloridrato de clorfenoxamina, 8-cloroteofilina e cafeína na forma de dosagem multicomponente foi conduzida por um método cromato-densitométrico em camada fina. Gil et al. investigaram o comportamento eletroanalítico da 8-cloroteofilina por voltametria cíclica e por polarografia de pulso diferencial e determinaram seu conteúdo em preparações farmacêuticas por polarografia de pulso diferencial. A estabilidade indicando o método RP-HPLC foi desenvolvida e validada para a 8-cloroteofilina junto com a difenidramina e a cafeína. Também foram desenvolvidos métodos espectrofotométricos e quimiométricos para determinação simultânea de cafeína, 8-cloroteofilina e clorfenoxamina hidroclorada em misturas ternárias. Até o momento, nenhum método cromatográfico e espectroscópico foi relatado para separação e caracterização das impurezas presentes na 8-cloroteofilina. Portanto, o presente trabalho foi realizado com o objetivo de isolar e caracterizar as impurezas presentes na 8-cloroteofilina usando técnicas analíticas modernas.
8-Chlorotheophylline foi uma amostra de presente da Kores (India) Ltd., Thane. Todos os outros produtos químicos e reagentes foram obtidos da S. D. Fine Chemicals Ltd (Mumbai, Índia). Os solventes utilizados para estudos de TLC e TLC preparativos foram de grau analítico e os utilizados para estudos de HPLC foram de grau HPLC. O acetato de sódio tri-hidratado de grau AR foi utilizado para a preparação de tampão.
Estudos de TLC foram realizados a fim de conhecer o número de impurezas presentes na amostra. Placas de TLC pré-revestidas de Silica gel 60GF254 (Merck) foram utilizadas como fase estacionária. A amostra foi dissolvida em quantidade mínima de acetato de etilo e esta solução foi utilizada para a detecção das placas de TLC. Várias fases móveis foram experimentadas. Acetato de etilo:tolueno:ácido acético glacial (10:0.3:0.5 v/v/v) mostrou melhor separação em comparação com outras fases móveis. Quatro componentes foram separados da amostra de 8-cloroteofilina usando TLC com os valores Rf de 0,029, 0,132, 0,198 e 0,852, respectivamente. A 8-cloroteofilina teve um Rf de 0,852.
Após o desenvolvimento da fase móvel para TLC, foi feita uma tentativa de separar a mistura usando TLC preparativo. A amostra foi dissolvida em quantidade mínima de acetato de etilo e manchada em forma de banda. Todas as três impurezas foram separadas da 8-cloroteofilina por TLC preparativa usando as mesmas condições cromatográficas usadas em estudos de TLC. As diferentes bandas foram coletadas separadamente e extraídas com acetato de etilo. Como as quantidades de cada impureza isolada I, II e III eram muito menores, foi decidido isolar essas impurezas coletivamente. As impurezas I, II e III foram designadas coletivamente como fração I. A fração I foi isolada da 8-cloroteofilina por TLC preparativa. Como cada impureza não foi isolada separadamente, não foi possível realizar diferentes técnicas de identificação, como IR, NMR. Decidiu-se realizar mais investigações utilizando LC-MS, o que permite a separação e caracterização simultânea. Antes da análise do LC-MS, foi desenvolvido o perfil de HPLC para a fração I. Um cromatógrafo líquido de alto desempenho da Tosoh equipado com bomba alternativa CCPM, um controlador de bomba PX8010 e um detector UV foi utilizado para estudos de HPLC. Um laço de 20 µl de capacidade foi instalado na unidade da válvula de injeção. A fracção I foi dissolvida em acetonitrilo e submetida a análise por HPLC de fase reversa com fase móvel composta por acetonitrilo: acetato de sódio tri-hidratado (pH 3,57; 0,01 M) (5:95 v/v). A coluna selecionada foi Phenomenex ODS (250×4,6 mm I.D.; tamanho da partícula 5 µm). A vazão foi de 1,5 ml/min e a detecção foi monitorada a um comprimento de onda de 280 nm. A fase móvel foi filtrada através do filtro de vidro sinterizado G5 sob vácuo antes do uso e filtrada para remover bolhas de ar. A análise por HPLC da fração I também revelou três picos com tempos médios de retenção de 8,324 min, 14,275 min e 20,933 min, respectivamente (fig. 1). Pico com tempo médio de retenção de 2,086 min foi o pico do solvente.
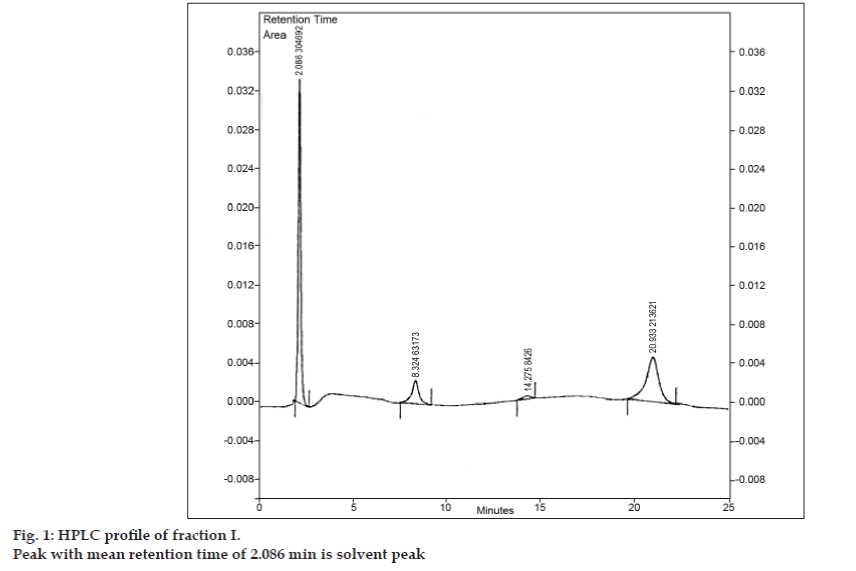
Figure 1: Perfil HPLC da fração I.
Fração I foi então submetido à análise LC-MS para caracterização das impurezas. Os estudos LC-MS foram realizados num sistema em que a parte LC consistia em HPLC da série 1100 (Agilent Technologies, USA) composta por um desgaseificador a vácuo (G1322A), bomba quaternária (G1311A), um amostrador automático (G1313A) e um detector UV/visível (G1314A) e a parte MS consistia em espectrómetro de massa quadrupolar triplo Quattro II (Micromass UK Ltd., UK).
Em estudos LC-MS, as separações cromatográficas líquidas foram obtidas pela coluna Phenomenex C18 (250×4,6 mm, 5 µm) à temperatura ambiente com a fase móvel do acetonitrilo: tampão de acetato de sódio (5:95, v/v) a uma taxa de fluxo de 1,5 ml/min. O espectrômetro de massa foi executado em modo de ionização positiva por spray de elétrons (ESI) com relação massa/carga (m/z) na faixa de 120-500 m/z. O nitrogênio foi utilizado como gás nebulizador. Os dados foram adquiridos e processados pelo software Masslynx. Dados espectrais de massa das impurezas foram obtidos (figs. 2, 3 e 4). A via de fragmentação para três picos é caracterizada pela perda do grupo metilo e/ou grupo carbonilo. Picos com valores m/z de 180,9, 195,7 e 214,9 correspondem a picos +, + e +, respectivamente. De acordo com os dados de EM obtidos, as impurezas eluídas a 8,324 min, 14,275 min e 20,933 min foram teofilina (mol. wt. 180), cafeína (mol. wt. 194) e um isômero de 8-cloroteofilina (mol. wt. 214,5), respectivamente (Tabela 1). Assim, três impurezas foram separadas e suas estruturas foram elucidadas com base em dados espectrais de massa (Esquema 1).
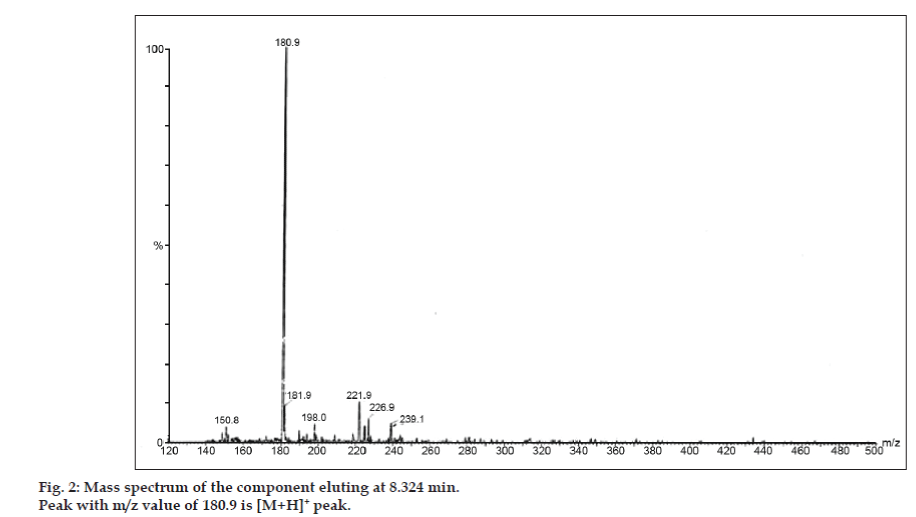
Fig 2: Espectro de massa do componente eluído a 8,324 min.
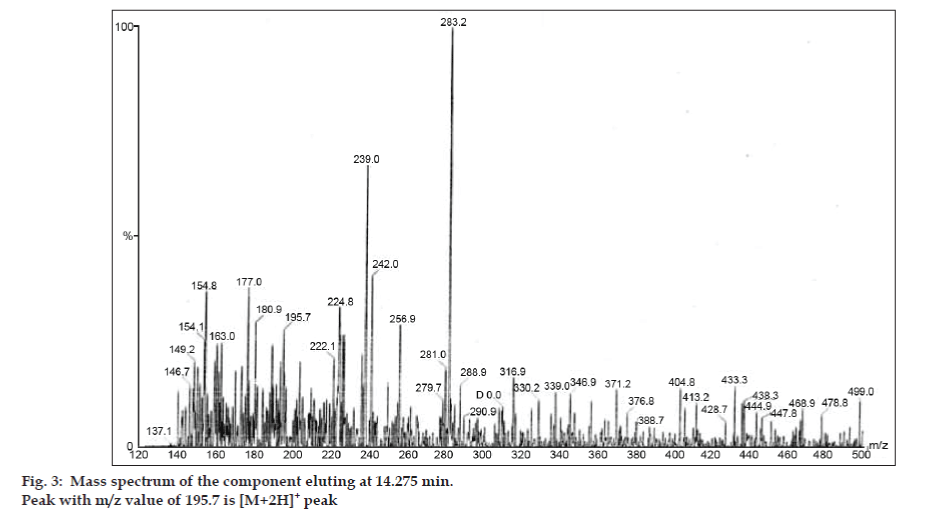
Fig. 3: Espectro de massa do componente eluindo a 14,275 min.
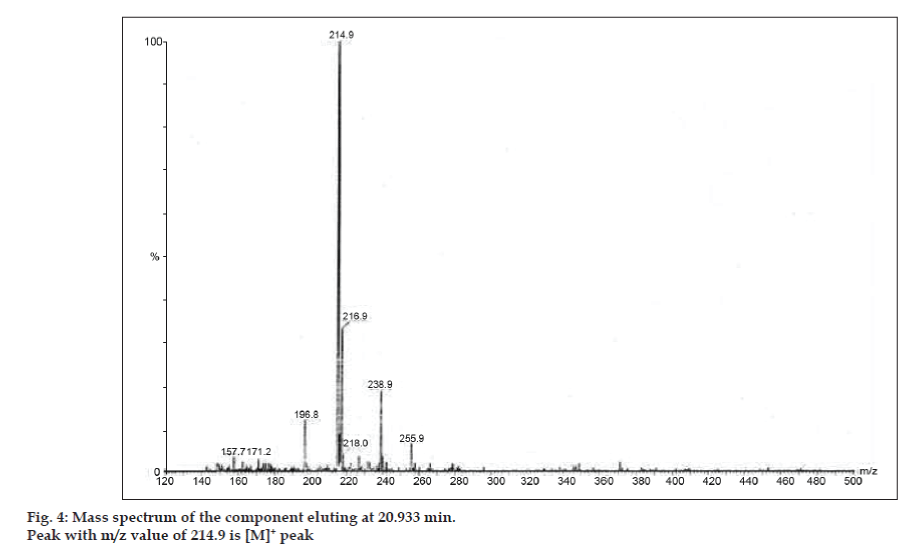
Figure. 4: Espectro de massa do componente eluindo a 20,933 min.
| Peak não. |
Retenção tempo (min) |
Iões fragmentos (m/z) | Identificação |
|---|---|---|---|
| 8.324 | 181,9 +, 180,9 +, 150,8 + | Teofilina | |
| 14.275 | 195,7 +, 180,9 +,149,2 +, 137,1+ | Cafeína | |
| 20,933 | 216.9 +, 214,9 +, 171,2 +, 157,7 + | Isomer de 8- Cloroteofilina |
TÁBULO 1: IDENTIFICAÇÃO HPLC-MS DA FRACÇÃO I
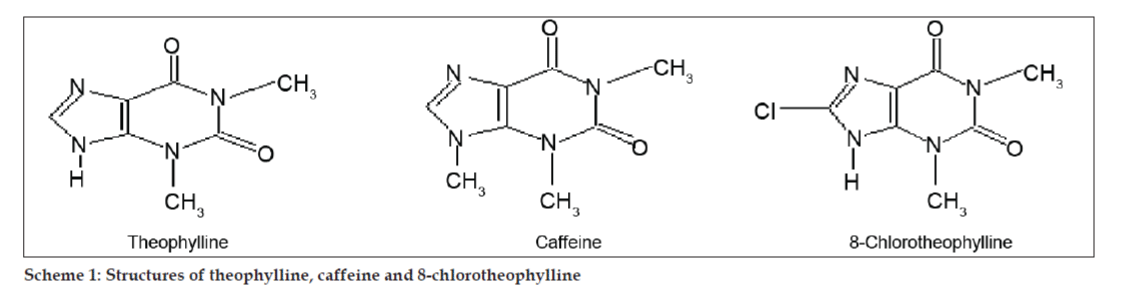 >
>Esquema 1: Estruturas de teofilina, cafeína e 8-cloroteofilina
Conhecimento
Autores agradecem à Kores (India) Ltd, Thane por fornecer uma amostra de 8-clorotefilina.
- Kasture AV, Wadodkar SG, Mahadik KR, More HV. Análise Farmacêutica. Vol. 1. Pune: NiraliPrakashan; 1997. p. 12-4.
- United State Pharmacopoeia, Vol. 26. Rockville, MD: United States Pharmacopoeia Convention, Inc.; 1999. p. 2049-59.
- Ahuja S, Alsante KM. Handbook of isolation and characterization of impurities in pharmaceuticals (Manual de isolamento e caracterização de impurezas em produtos farmacêuticos). Califórnia: Academic Press; 2003. p. 6.
- Foye WO, Lemke TL, Williams DA. Principles of Medicinal Chemistry. 4ª ed., Lemke TL, Williams DA. Nova Delhi: B. I. Waverly Pvt Ltd; 1995. p. 419.
- Reynolds JE. Martindale-The Extra Pharmacopoeia. 29ª ed. Londres: Imprensa Farmacêutica; 1989. p. 451.459.
- Wadke DA, Guttman DE. Influência da formação complexa na taxa de reacção III. Interação de algumas revistas isoaloxinas com 8-cloroteofilina como determinado por métodos espectrais, solubilidade e cinéticos. J Pharm Sci 1965;54:1293.
- Bennett MJ, Patchett BP, Worthy E. Um método HPLC simples para a determinação da taxa de ureia em soro e urina usando 8-cloroteofilina como padrão interno. Med Lab Sci 1984;41:108-11.
- Nikolic K, Medenica M. Determinação potenciométrica da 8-cloroteofilina. Microchimica Acta 1986;88:5.
- Bebawy LI, El-Kousy NM. Determinação simultânea de algumas formas de dosagem multicomponentes por método densitométrico de cromatografia quantitativa em camada fina. J Pharm Biomed Anal 1999;20:663-70.
- Gil EP, Blazquez LC, Garcia-MoncoCarra RM, Misiego AS. Polarographic Behavior of 8-Chlorotheophylline and its Determination in Dosage Forms. Electroanálise 1993;5:343.
- Barbas C, Garcia A, Saavedra L, Castro M. Optimização e validação de um método para a determinação de cafeína, 8-cloroteofilina e difenidramina por cromatografia líquida isocrática de alta performance Teste de esforço para avaliação da estabilidade. J ChromatogrA 2000;870:97-103.
- Kelani KM. Determinação simultânea de cafeína, 8- cloroteofilina e clorfenoxamina cloridrato em misturas ternárias pelos métodos espectrofotométrico e quimiométrico de primeira derivação de ratio-espectra zero-cruzamento. J AOAC Int 2005;88:1126-34.