| Ed Davis, Ph.D. |
Introdução
Lentivirus e Adeno-associated virus (AAV) provaram ser inestimáveis para a introdução de material genético em células de mamíferos, seja em cultura ou em animais inteiros. Ambos os sistemas são altamente amenizáveis para muitas aplicações básicas de pesquisa, tais como superexpressão de proteínas, produção de anticorpos e nocaute de genes, e ambos são promissores para a terapia genética. Entretanto, cada sistema viral tem suas próprias vantagens e desvantagens únicas, dependendo da aplicação. GeneCopoeia oferece extensas linhas de produtos tanto para lentivírus como para AAV, fornecendo-lhe opções poderosas e flexíveis para fornecer DNA às células. Nesta Nota Técnica, descrevemos as tecnologias por trás das linhas de produtos GeneCopoeia Lentifect™ lentivirus e AAVPrime™ AAV, e discutimos os méritos de cada tecnologia para várias aplicações, a fim de ajudá-lo a escolher o sistema que melhor atende às suas necessidades.
Por que usar vírus para entrega de DNA?
Uma das formas mais comuns de entrega de DNA às células é através da transfecção à base de plasmídeos, em que as células são tratadas com compostos químicos como fosfato de cálcio, ou com reagentes à base de lipídios. No entanto, a transfecção com plasmídeos nem sempre é desejável ou prática. Por exemplo, algumas células são muito difíceis ou impossíveis de transferir, enquanto a maioria das células cultivadas suportam a infecção (também conhecida como transdução) por lentivírus ou AAV. Em segundo lugar, a transfecção plasmídica não pode ser usada para a entrega de DNA in vivo, mas a transdução viral pode. Ambos lentivírus e AAV podem ser usados para uma variedade de aplicações, como expressão de proteínas a partir de quadros de leitura abertos (ORFs), derrubamento de genes por interferência do RNAi (RNAi) mediado pelo RNA (shRNA), luciferase e outros ensaios de genes repórteres, e derrubamento de genes mediado pelo sistema agrupado de repetições palindrómicas curtas, regularmente espaçadas – Cas9 (CRISPR-Cas9). Muitas dessas aplicações para vetores virais têm sido realizadas com sucesso em culturas de linhas celulares imortalizadas de mamíferos, cultura primária de células, modelos animais e em terapia gênica em pacientes humanos.
Sistemas lentivíricos
O termo “lentivírus” refere-se à classe de retrovírus que inclui o vírus da imunodeficiência humana (HIV), e, de fato, a maioria dos sistemas lentivíricos atualmente em uso são derivados do HIV (revisado em Mátrai, et al, 2010; Sakuma, et al., 2012). Os lentivíricos portadores de transgenes integram-se no genoma após a infecção, permitindo assim uma expressão estável tanto em células divididas como não divididas.
Os sistemas lentivíricos têm sido altamente modificados a partir do HIV ao longo de várias gerações para torná-los seguros no manuseio e úteis para aplicações. GeneCopoeia usa o sistema lentiviral de terceira geração (Dull, et al. 1998), que requer quatro plasmídeos separados para produzir partículas virais infecciosas (viriões). Um plasmídeo GeneCopoeia lentiviral carrega apenas o gene de interesse (GOI) a ser expresso, um gene de selecção antibiótica e as sequências de sinal de embalagem. Algumas vezes o clone também incluirá um gene de repórter fluorescente. O plasmídeo contendo GOI, com o marcador selecionável e o gene repórter, pode acomodar inserções de até cerca de 5-6 kb. (Figura 1), embora os títulos virais caiam drasticamente quando os tamanhos das inserções excedem cerca de 4 kb.
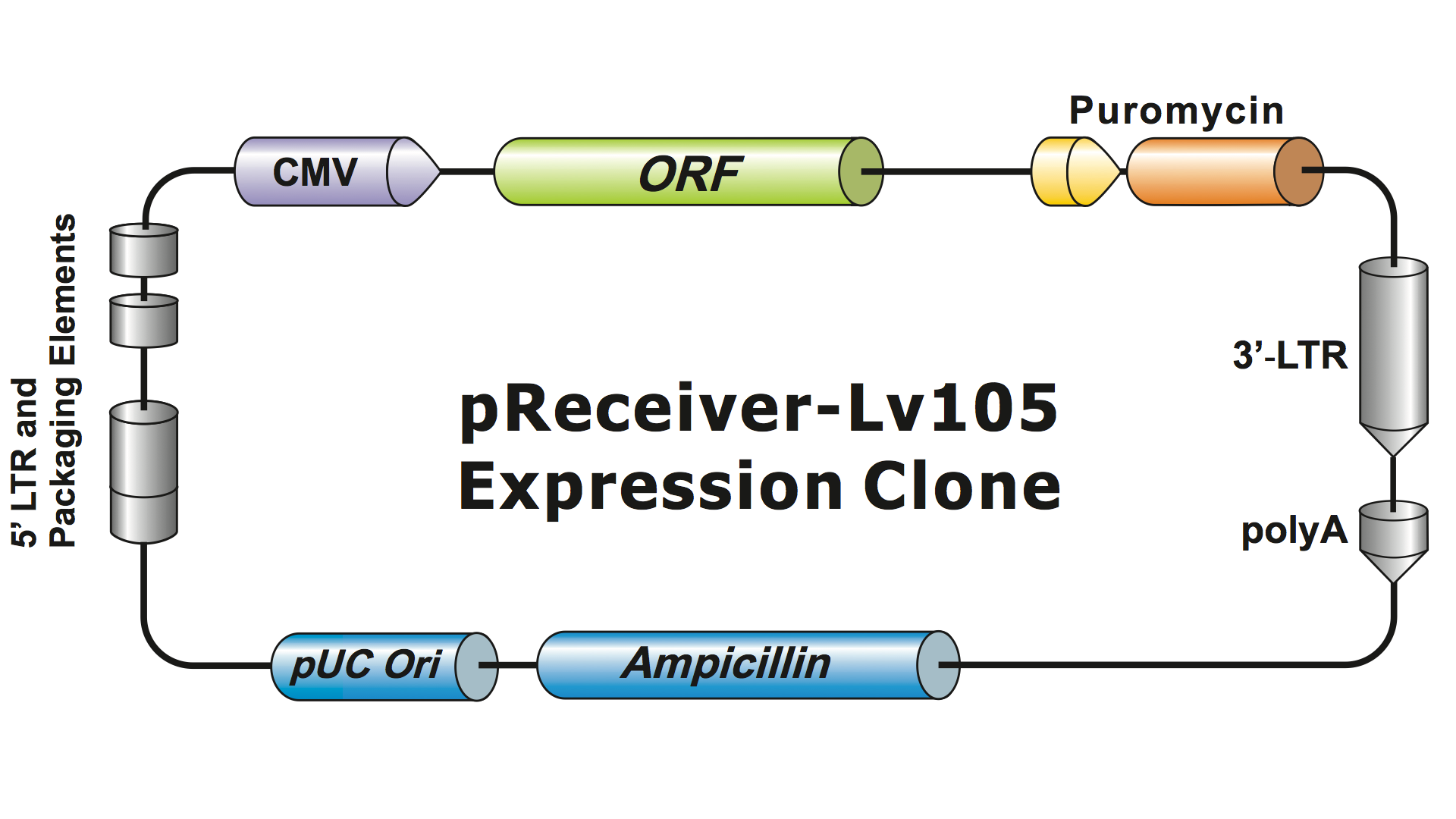 |
Figure 1. Exemplo de um clone de expressão lentiviral GeneCopoeia |
Os plasmídeos adicionais expressam os elementos retrovirais necessários para embalagem e integração (gag, pol, env, Rev). Quando todos os quatro plasmídeos são expressos em células de embalagem, o RNA do GOI é incorporado em partículas. Como as proteínas retrovirais são expressas apenas durante a embalagem, as células infectadas não podem produzir vírus infecciosos. Além disso, as partículas lentivíricas do GeneCopoeia Lentifect™ contêm uma eliminação na região U3 dos LTRs, tornando-as auto-inactiváveis (SIN). A eliminação do SIN impede a replicação lentiviral no raro caso de os quatro plasmídeos se recombinarem para criar um único plasmídeo ativo do vírus. Portanto, as partículas lentivíricas são seguras de manusear, sem praticamente nenhuma chance de gerar vírus patogênicos.
Além das modificações de segurança aprimorada, as partículas lentivíricas do GeneCopoeia Lentifect™ carregam a glicoproteína do vírus da estomatite vesicular G (VSV-G) no lugar do gene selvagem do HIV env, que muda o tropismo tecidual do vírus de células T CD4+ para praticamente qualquer tipo de célula de mamíferos. Como tal, os lentivírus são um sistema amplamente utilizado para a cultura de células de mamíferos, modelos animais e aplicações de terapia genética.
Porque os vectores lentivíricos foram modificados desta forma, os sistemas lentivíricos do GeneCopoeia Lentifect™ aumentaram a segurança, e têm as seguintes características que os tornam altamente úteis para o fornecimento de ADN:
- Infectam quase todos os tipos de células de mamíferos
- Podem ser usados para fornecer sequências de ADN relativamente grandes até cerca de 5-6 kb de comprimento
- Podem ser usados para gerar linhas celulares estáveis, ou conduzir expressão genética estável em órgãos e tecidos in vivo, devido à integração do transgene em locais aleatórios no genoma
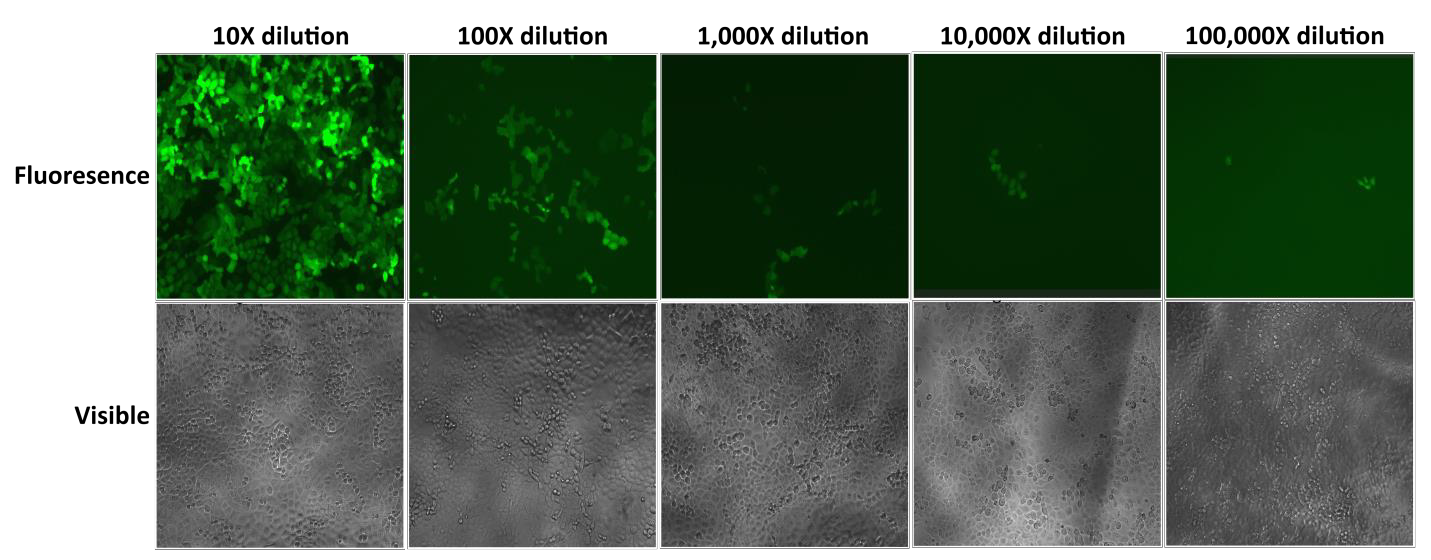
GeneCopoeia’s Lentifect™ partículas lentivíricas fornecem títulos altos, permitindo aos pesquisadores expressar genes de interesse de forma eficiente (Figura 2).
|
Figure 2. Teste de diluições em série de Lentifect™ partículas lentivíricas. A fluorescência eGFP foi fotografada com um microscópio de fluorescência 72 horas pós-trandução. |
|
GeneCopoeia oferece uma das linhas mais extensas de produtos lentivíricos da indústria (Tabela 1).
| Produto/serviço | Descrição |
| Clones lentivirais e vetores de clonagem | Clones pré-fabricados e personalizados com ORFs, promotores, shRNAs, miRNA 3′ UTRs, precursores e inibidores, sgRNAs, e muito mais. Disponível com múltiplos promotores, tags e repórteres. Vetores para clonagem “faça você mesmo” de sequências de interesse. |
| Lentifect™ partículas lentivíricas | Partículas lentivíricas pré-fabricadas e embaladas à medida, prontas a usar. Produzido a partir das coleções extensivas de clones da GeneCopoeia ou de clones apresentados pelos clientes. |
| Reagentes de Embalagem Lentiviral da GeneCopoeia | Sistema completo de reagentes para a produção de partículas lentivíricas do tipo faça-você-mesmo. Inclui plasmídeos de embalagem, linha de células de embalagem, solução de concentração de partículas e kit de titulação. |
Tabela 1. Linha de produtos e serviços de GeneCopoeia lentiviral.
Sistemas baseados em AAV
Em contraste com o genoma RNA de lentivírus, AAV tem um único genoma de ADN irrecuperável (Samulski e Muzyczka, 2014). Além disso, o AAV não é derivado de um patógeno, mas sim de um contaminante de adenovírus, sem condições patogênicas atribuídas a ele. A AAV naturalmente ocorre e se integra ao genoma como lentivírus, mas somente no locus da AAVS1 no cromossomo 19. Este site também é conhecido como “Safe Harbor”, porque é comumente usado para a inserção de transgênios sem prejudicar as células (DeKelver, et al., 2010).
Lenitivírus, AAV foi modificado para segurança e usabilidade. A AAV requer co-infecção com um vírus auxiliar. O genoma AAV tem 4.7 kb de comprimento e contém 2 genes, Rep e Cap, que são necessários para a replicação e integração viral. Em AAVPrime™, Rep e Cap são eliminados, deixando apenas as repetições terminais invertidas de 145 bp 5′ e 3′ (ITRs). A eliminação do Rep e da Tampa serve três propósitos: 1) Elimina a capacidade de um vírus auxiliar para permitir que as células infectadas com AAV produzam novos viriões AAV; 2) Permite a inserção de genes até aproximadamente 4 kb de comprimento (embora o título viral diminua com transgenes com mais de 3 kb); e 3) Elimina virtualmente a capacidade de integração do AAV. O pequeno tamanho da AAV apresenta desafios para algumas aplicações. Por exemplo, para a edição do genoma CRISPR, os pesquisadores usam o Cas9 nuclease de S. aureus, porque ele é cerca de 30% mais curto que o mais comumente usado S. pyogenes Cas9 (Ran, et al, 2015).
Para o empacotamento, Rep e Cap foram movidos para um plasmídeo diferente, e os genes ajudantes do Adenovirus são colocados num terceiro plasmídeo, tornando todo o sistema de empacotamento seguro e livre de vírus ajudantes (Figura 3).
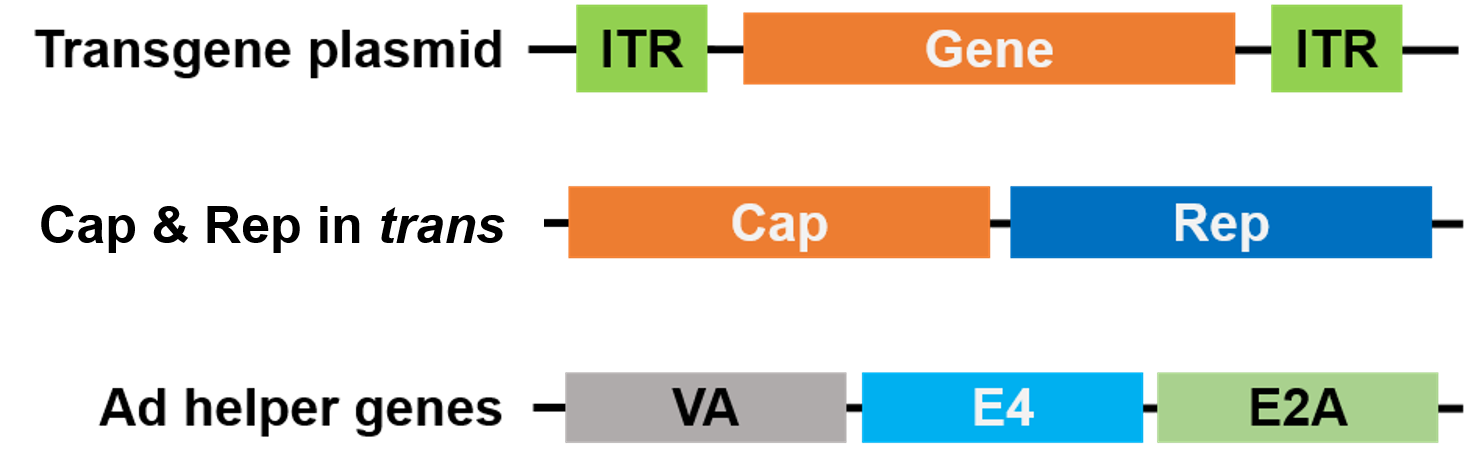 |
Figure 3. Ajudante de AAV livre de vírus. 3 plasmídeos são usados para embalagem. O gene do plasmídeo de interesse (topo) contém as repetições terminais invertidas (ITRs). Um segundo plasmídeo (médio) carrega os genes AAV Cap e Rep, e o terceiro plasmídeo (inferior) carrega os genes necessários do Adenovírus (Ad) |
Outros, o AAV existe em diferentes serotipos, que afetam a especificidade tecidual da infecção pelo AAV. Os múltiplos serotipos permitem aos investigadores a) infectar uma vasta gama de células hospedeiras; ou b) limitar a infecção a um ou poucos tecidos. GeneCopoeia AAVPrime™ As partículas de AAV estão disponíveis em múltiplos serótipos (Tabela 2).
| Serótipo | Tipo alvo primário | Descrição |
| AAV-1 | Músculo | Melhor para músculo cardíaco, músculo esquelético, tecido neuronal e glial. |
| AAV-2 | Músculo, Fígado, Retina | Sorotipo mais comumente utilizado. Melhor para neurónios, músculo, fígado e cérebro. |
| AAV-3 | Megacariócitos | Melhor para megacariócitos, músculo, fígado, pulmão e retina. |
| AAV-4 | Retina | Melhor para neurónios, músculo, cérebro, e retina. |
| AAV-5 | Pulmão | Melhor para pulmão, neurónios, articulação sinovial, retina e pâncreas. |
| AAV-6 | Músculo, pulmão | Melhor para pulmão, fígado e coração. |
| AAV-7 | Músculo, Retina, Neurónios | Melhor para músculo, neurónios e fígado. |
| AAV-8 | Fígado | Melhor para músculo, cérebro, fígado e retina. |
| AAV-9 | Variante | Melhor para músculo, coração, fígado, pulmão e cérebro. |
| AAV-10 | Pleura, CNS | Clonado de Cynomolgus, quase idêntico ao AAVrh10 excepto para 12 aminoácidos em VP1. Melhor para pulmão, músculo, coração, NCS e fígado. |
| AAV-DJ | Vários | Mistura de 8 serotipos que ocorrem naturalmente. Transduz eficientemente uma grande variedade de tipos celulares in vitro. |
| AAV-DJ/8 | Variável | Uma variante de AAV-DJ com uma mutação de domínio de ligação à heparina (HBD), que permite a infecção do fígado, bem como de outros tecidos in vivo. |
Tabela 2. Lista de serótipos AAV amplamente utilizados
AAVPrime™ Partículas AAV têm as seguintes características que as tornam altamente úteis para a entrega de DNA:
- Títulos altos. O título das partículas purificadas pode ser de até 10^14 GC/ml (cópias do genoma/ml)
- Versátil. Múltiplos serotipos permitem o uso em uma ampla ou limitada gama de células hospedeiras
- Baixa toxicidade. Não se integra no genoma hospedeiro.
- Baixa imunogenicidade. Resposta imunológica mínima do hospedeiro.
- Seguro. Não associado a nenhuma doença humana
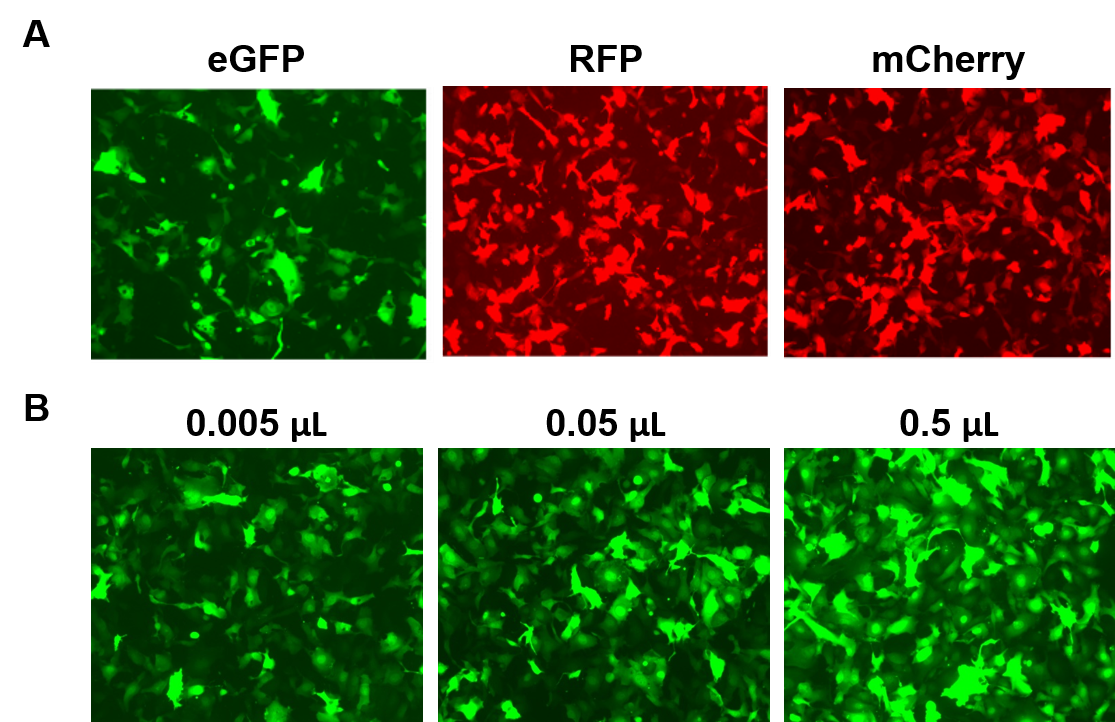
AAVPrime™ partículas estão disponíveis para humanos e ORFs de rato até 3 kb, em múltiplos serótipos e opções de promotores, quer na pureza padrão (apenas para uso in vitro) ou purificada (para uso in vivo). Os clientes podem encomendar clones plasmídicos, partículas geradas por encomenda para genes de interesse, ou escolher entre opções pré-fabricadas que expressem genes como os repórteres fluorescentes (Figura 4).
|
Figure 4. Desempenho das partículas do GeneCopoeia AAVPrime™. A. Células HT1080 em placas de 24 poços transduzidas com 0,5 µL de pureza padrão AAV expressando GFP (eGFP), proteína vermelha fluorescente (RFP), e cereja monomérica (mCherry). B. Células HT1080 em placas de 24 poços foram transduzidas com quantidades variáveis de AAV purificado, expressando eGFP. As células foram visualizadas com um microscópio de fluorescência (Tempo de exposição: 400 ms). |
|
Que devo escolher: Lentivírus ou AAV?
A escolha entre lentivírus e AAV depende de muitos factores. Por exemplo, o facto de os lentivírus se integrarem no genoma pode ser tanto uma vantagem como uma desvantagem, dependendo de quais são as suas necessidades. Consulte a tabela abaixo para ajudá-lo a decidir:
| Integrações maiores | Integração estável | Não integração | Específica de célula/tecido | Segurança in vivo | |
| Lentivírus | ✔︎ | ✔︎ | |||
| >AAV | ✔︎ | ✔︎ | ✔︎ |
Para saber mais sobre os sistemas virais da GeneCopoeia e para encomendar, visite nosso site (https://www.genecopoeia.com/product/lentiviral-system/)
Conclusões
Na GeneCopoeia, nós nos esforçamos para lhe fornecer a mais alta qualidade, tecnologia de ponta em produtos para Genômica Funcional e Biologia Celular. Oferecemos uma ampla gama de produtos desde conjuntos de clones de DNA plasmídeo para ORFs, promotores genéticos, miRNAs, shRNA e CRISPR, até poderosos kits e reagentes, passando por produtos para sondas de estrutura celular fluorescente, quantificação de ácidos nucléicos e anticorpos rotulados. Para saber mais, visite o nosso website, www.genecopoeia.com, ou contacte-nos em [email protected].
DeKelver, et al. (2010). Genômica funcional, proteômica e análise regulatória de DNA em ambientes isogênicos usando transgênese acionada pelo núcleo do dedo de zinco em um local seguro no genoma humano. Genoma Res 20, 1133.
Dull, et al. (1998). Um Vector Lentivírus de Terceira Geração com um Sistema de Empacotamento Condicional. J. Virol. 72, 8463.
Ran, et al. (2015). Edição in vivo do genoma usando Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Vetores lentivíricos: básicos a translacionais. Biochem. J. 443, 603.
Samulski e Muzyczka (2014). AAV-Mediated Gene Therapy for Research and Therapeutic Purposes (AAV-Mediated Gene Therapy for Research and Therapeutic Purposes). Annu. Rev. Virol. 1, 427.