Introdução
Fechamento da parede abdominal primária após um transplante isolado de intestino delgado ou órgão multivisceral continua sendo um dos desafios mais importantes a resolver nesta área. A grande maioria destes pacientes apresenta complicações no fechamento da parede, que podem ser atribuídas à distensão intestinal devido à síndrome de isquemia-reperfusão, edema intestinal associado e inelasticidade da cavidade abdominal, que geralmente é reduzida em volume após um histórico de múltiplas operações e infecções associadas, colocação de estoma e alta incidência de fístulas prévias.1,2 Estas circunstâncias aumentam o risco de síndrome compartimental, que pode levar à isquemia ou necrose do enxerto.3 Como resultado, cerca de 20%-50% dos receptores deste tipo de enxerto necessitarão de uma técnica cirúrgica alternativa ao fechamento primário da parede abdominal convencional.4-6 Em geral, dada a perda da estrutura da parede nestes receptores, eles são considerados candidatos pobres para cirurgia reconstrutiva, como a separação de componentes ou retalhos musculocutâneos.
Isto pode ser resolvido ou tratado pela redução do tamanho do enxerto, ou pela expansão da capacidade do receptor. A tendência geral de escolher doadores com pesos menores, com uma relação entre 1,1 e 0,757 ou mesmo para reduzir o tamanho dos enxertos8,9 facilita o fechamento sem tensão em muitos casos.1 Técnicas de fechamento da parede utilizando malha convencional (absorvível ou não) ou malha biológica10 têm apresentado resultados decepcionantes, provavelmente devido a uma combinação de tensão no fechamento e aos efeitos de altas doses de drogas imunossupressoras. O uso de fechamento abdominal encenado, defendido pelo grupo de Birmingham com 23 casos combinando próteses de nylon sintético (Silastic@) e terapia de pressão negativa, poderia ser uma alternativa.11 O fechamento isolado da pele é às vezes possível, apesar da camada muscular inferior não apresentar tanta elasticidade. Intervenções têm sido propostas inclusive com uma série de operações utilizando expansores, que não parecem muito recomendáveis devido às altas taxas de complicações (infecção, hérnia, fístula, seroma/hematoma, obstrução intestinal, extrusão de malha, etc.).12,13
O uso de transplante total ou parcial da parede abdominal do mesmo doador do enxerto intestinal ou multivisceral, desenvolvido por Levi et al. desde 2003,3 podem ser uma alternativa interessante neste contexto, pois apresentam vantagens óbvias em termos de obtenção de um fechamento sem tensão com enxerto em normoposição bem vascularizado, evitando as complicações infecciosas da malha que podem levar à rejeição (apresentação como erupção maculopapular),14 o que se consegue em uma única cirurgia.2 As experiências iniciais de 15 e 17 pacientes têm mostrado bons resultados.2,15
Estado atual dos transplantes de parede abdominal no transplante de órgãosTransplante de espessuras parciaisFáscia não vascularizada
Existem duas técnicas básicas de extração descritas na literatura:
- –
Miami técnica3: consiste na remoção completa da parede abdominal como se fosse um enxerto completo, em bloco, para posteriormente separar a lâmina anterior da fáscia do reto.
- –
Mount-Sinai/Favaloro técnica16: é feita uma incisão cruzada no tecido subcutâneo e na pele, ressecando a lâmina anterior da fáscia anterior do reto em bloco através de uma incisão subcostal bilateral com peritônio.
Em ambos os casos, o enxerto torna-se independente do resto do retalho no final da extração, após a perfusão, que não é síncrona com o resto dos órgãos extraídos. O enxerto é colocado em solução de preservação e o excesso de tecido e músculo é removido na bancada.
Em nosso hospital, ambas as artérias ilíacas externas do doador são canuladas e o retalho completo do enxerto é perfurado; posteriormente, uma técnica de extração muito semelhante ao método de Miami é realizada. O objetivo é obter um enxerto completo do doador (Fig. 1) para posteriormente decidir o tipo de enxerto e fechamento da parede requerido pelo receptor (dependendo dos exames de imagem pré-operatórios, especialmente a tomografia computadorizada volumétrica, que deve ser confirmada pelo estado tecidual no momento do implante).
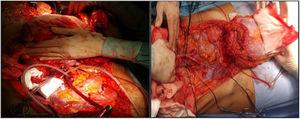
Canulação das artérias ilíacas externas (não é necessário canular as veias) e preparação do enxerto para a extração.
Embora a maioria das séries realize a perfusão do enxerto de parede com solução de preservação do Wisconsin, em nosso hospital sentimos que o uso da solução Celsior é superior devido à sua menor viscosidade, embora não haja evidências suficientes na literatura a esse respeito.17
Subseqüentemente, na bancada, o tipo de enxerto é decidido de acordo com as necessidades do receptor, sendo retirado o tecido desnecessário (Fig. 2). No caso da fáscia não vascularizada, a excisão de gordura e tecido muscular é importante porque, sem suporte circulatório, seria muito suscetível a desenvolver necrose e tornar-se uma fonte de infecção.
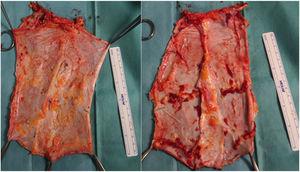
Exemplos de enxertos de fáscia não vascularizados.
Fáscia não vascularizada
Esta é indicada em casos de implantes hepáticos isolados e aqueles combinados com transplantes intestinais. A extração hepática seria realizada em associação com o ligamento falciforme e a lâmina posterior da bainha do reto, que manteria um certo grau de fluxo da artéria do ligamento falciforme (geralmente do fígado esquerdo) e drenagem através da veia umbilical, com vascularização parcial do peritônio e lâmina posterior da bainha do reto (Fig. 3). A artéria do ligamento falciforme aparece em 67% das necropsias, embora apenas em 2%-24% das angiografias.18 Parece uma opção muito interessante em doadores e receptores pediátricos, já que em adultos é obliterada. Aparentemente, este enxerto tem maior resistência à infecção do que a fáscia não vascularizada e maior integração com o tecido circundante. O grupo de Chicago19 necessitou acessar a cavidade de um receptor até 3 vezes, observando boa viabilidade da lâmina (apesar disso, o paciente morreu 51 dias depois devido a uma infecção fúngica). Nos casos da Duke University,20 foi utilizada como uma espécie de malha de reforço para fechamento, sem complicações aparentes em ambos os casos (Tabela 1).
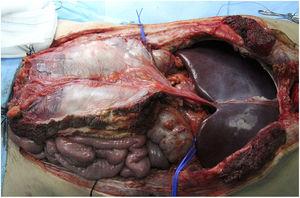
Exemplo de extração da fáscia vascularizada em nosso hospital; ao final, seu uso não foi necessário.
| Hospital | Tipo de Anastomose Vascular | N de Casos | Complicações | |
|---|---|---|---|---|
| Tx espessura da parede inteira | ||||
| Miami4 (2003) | Ilíaca Macrovascular-ilíaco | 12 (6 IT; 4 MOT; 2 MMOT) | Trombose (2)Fechamento secundário (2)Infecções (7) | |
| Oxford2 (2008-2014) | Microvascular epigastric-ilíaca | 17 casos (12 IT; 5 MMOT) | Infecções (6)DAGVH (2)Rejeição aguda (5) | |
| Bolonia21 (2005) | Microvascular epigástrica…ilíaco | 3 casos (3 IT) | Síndrome linfoproliferativa (1) | |
| Chennai (Vayda et al. Resultados não publicados) (2015) | Microvascular epigástrico-ilíaco | 1 caso (1 IT) | ||
| Indiana (Viana et al. Resultados inéditos) (2013) | Iilíaca Macrovascular | 1 caso (1 IT) | ||
| Groningen23 (2016) | Microvascular epigastric-ilíaco | 1 caixa (1 IT) | ||
| Tx fascia vascularizada | ||||
| Oxford2 (2007) | 1 caixa (1 IT) | |||
| Chicago19 (2010) | 5 caixas (1 LKT, 4 TH) | Sepsis (1)Fechamento secundário (2) | ||
| Universidad Duke20 (2012) | 2 casos (2 MOT) | |||
| Tx nãofascia vascularizada | ||||
| Miami24 (2009) | 13 casos (6 MOT, 4 TH, 2 MMOT, 1 LIT) | Infecções (7)Retirada (2) | ||
| Oxford2 (2007) | 1 caixa (1 IT) | |||
| Argentina16 (2007) | 19 caixas (13 IT, 4 MOT, 2 LIT) | Perdas de embarcações (3)Infecção (7/17) | ||
| Monte Sinai24 (2009) | 1 caixa (IT) | Sepsis (1) | ||
| Berlín25 (2012) | 5 casos (5 MOT) associados VAC | |||
| Hospital 12 de Octubre (2018) | 2 casos (1 IT, 1 MOT) | Sepsis (1) | ||
GVHD: enxerto-versus-hospedeiro; LT: transplante de fígado; LIT: transplante de fígado e intestino; LKT: transplante de fígado e rim; IT: transplante de intestino; MOT: transplante de múltiplos órgãos; MMOT: transplante modificado de múltiplos órgãos; Tx: transplante.
Transplante de parede abdominal com densidade total
Esta parece ser a alternativa mais fisiológica do ponto de vista anatômico. Historicamente, é o primeiro tipo de transplante de parede que foi realizado, o que é surpreendente, uma vez que é a técnica mais complexa, tanto para extração como para implante. A extração é feita em 2 etapas, no início e no final da extração de múltiplos órgãos. Desde o início da extração, é feita uma incisão de retalho de plena espessura “em casa”, deixando o retalho musculocutâneo mobilizado e ligado ao doador pelos vasos epigástricos inferiores. Uma vez realizada a extração de múltiplos órgãos, a aorta é canulada e o enxerto de parede é perfurado antes da extração e colocação em gelo com solução de preservação (Fig. 4). Em nosso hospital, é preferível a canulação seletiva de ambas as artérias ilíacas externas (ligando distal ao canal inguinal – artéria femoral – e na origem da artéria ilíaca externa) e independente do processo de perfusão dos demais órgãos a serem extraídos.
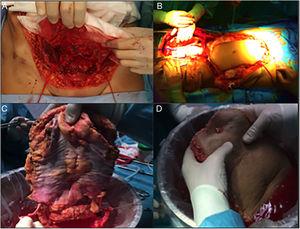
Fases de extracção do enxerto completo: (A) Dissecção dos vasos epigástricos inferiores; (B) Preparação das cânulas com o retalho “em casa”; (C) Dissecção em banco da arcada vascular epigástrica inferior; (D) Confirmação da perfusão.
De facto, é a solução para pacientes sem parede abdominal e mesmo pele para fechamento. Evitaria, portanto, a necessidade de reduzir o enxerto ou de limitar o conjunto de doadores em termos da relação peso do enxerto em relação ao peso do receptor de 0,75. Dado o peso dos receptores adultos em nosso meio, a competição por doadores pediátricos é comum, portanto a capacidade de expandir a faixa de peso garante uma maior amplitude e qualidade dos órgãos disponíveis.
Reconstrução do enxerto de parede é realizada de diferentes maneiras, dependendo da estrutura vascular e anatômica da parede receptora. Uma anastomose é normalmente utilizada entre um retalho da artéria ilíaca externa e a artéria epigástrica inferior do doador com a bifurcação das artérias ilíacas do receptor, devido ao seu maior diâmetro. O grupo Bolonia22 utiliza uma anastomose direta entre os vasos epigástricos inferior do doador e do receptor, exceto em um dos 3 casos em que a artéria circunflexa ilíaca superficial foi utilizada devido a uma lesão na artéria epigástrica inferior do receptor.
A possível detecção de rejeição de órgãos intestinais ou multiviscerais através de biópsias de parede tem sido proposta, embora estas possam não ser tão sensíveis ou específicas quanto as biópsias intestinais (nenhuma rejeição foi detectada no caso da Bolonia, mesmo que ela existisse no intestino); entretanto, elas poderiam ter grande valor de pesquisa.22
Nossa Experiência
Apresentamos os casos de 2 pacientes nos quais foi impossível realizar fechamento primário da parede abdominal ou cirurgia de reparo devido a vários procedimentos cirúrgicos antes do transplante.
Caso 1
A paciente é uma mulher de 50 anos de idade que havia sido encaminhada ao nosso hospital devido à síndrome do intestino curto secundária a múltiplas ressecções (6 intervenções) por isquemia mesentérica. Após 3 anos como candidata a transplante intestinal e devido à nutrição parenteral, desenvolveu doença hepática crônica e declínio da função renal, tornando-a candidata a transplante multivisceral. A paciente apresentou um defeito de parede abdominal muito significativo medindo 10cm de diâmetro transversal×15cm de comprimento, com a conseqüente diminuição do tamanho abdominal.
Um transplante de múltiplos órgãos foi realizado seguindo a técnica padrão. No momento do fechamento da parede, o defeito da parede abdominal era intransponível, associado à pele redundante significativa, o que previa o fechamento com a lâmina anterior não vascularizada da fáscia do reto do doador, sem a necessidade do enxerto abdominal completo. A paciente apresentou múltiplas complicações infecciosas que a levaram à morte (pneumonia e coleções abdominais), sem relação aparente com a parede abdominal nos exames de imagem realizados ou na autópsia. Nenhuma reoperação abdominal foi necessária após o transplante.
Case 2
Uma mulher de 60 anos de idade foi encaminhada ao nosso hospital devido a um tumor desmoidado com infiltração da parede abdominal. Ela havia sido submetida a 2 laparotomias prévias que confirmaram a incontinuidade devido ao extenso envolvimento da artéria mesentérica superior. Dois anos após ter sido adicionado à lista de espera, foi realizado um transplante de intestino isolado, seguindo a técnica padrão. No momento do fechamento, e devido à síndrome pós-reperfusão do enxerto, o defeito da parede abdominal era impossível de ser fechado (defeito de 16cm de comprimento x 20cm de largura). Foi realizado um transplante não vascularizado da lâmina anterior da bainha do reto, que previa o fechamento primário da pele (Fig. 5). O pós-operatório foi sem intercorrências, exceto por um episódio de leve rejeição, que exigiu a adição de everolimus ao regime imunossupressor com corticosteróides e tacrolimus. No exame de acompanhamento tomográfico foi observada excelente integração do retalho da fáscia (tomografia computadorizada normal, sem defeito de parede ou abaulamento observado), sem coleções ou sinais de infecção.
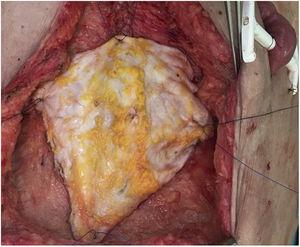
Posição definitiva do enxerto de fáscia não vascularizado.
Discussão
Tranplante de parede abdominal foi consolidado como uma alternativa válida para o fechamento da parede em pacientes que recebem outro transplante de órgão abdominal. Em até 40% dos casos, o fechamento da parede abdominal irá complicar o transplante multivisceral ou intestinal, portanto esta questão precisa ser resolvida.26 Os resultados a longo prazo, especialmente para enxertos vascularizados, prevêem um bom futuro, a ponto de ter demonstrado piloereção e um certo grau de contração muscular autonômica em alguns enxertos.27
A escolha de um ou outro tipo de enxerto baseia-se na necessidade de reparar a parede abdominal do receptor. Dependendo do tamanho do defeito, é priorizado o uso do enxerto que menos complique a implantação. Em muitos casos, o defeito é musculoaponeurotico e não necessita da espessura total adicional requerida pela adição de uma anastomose vascular dupla. A alternativa da fáscia vascularizada é limitada aos pacientes pediátricos que requerem pelo menos transplante hepático.
Embora os enxertos não vascularizados apresentem maior incidência de complicações, especialmente infecciosas, eles parecem uma alternativa razoável, especialmente em pacientes mais idosos com maior grau de aterosclerose, que dificulta o suporte vascular adequado ou acarreta risco adicional ao criar anastomoses.24 Essa carga aterosclerótica deve ser medida em receptores adultos por tomografia computadorizada com contraste arterial ao calcular a relação risco-benefício.
Em receptores pediátricos, as alternativas vascularizadas provavelmente ganham em importância. Benefícios como um diagnóstico potencial de rejeição, ou pelo menos uma amostragem menos invasiva com menos complicações potenciais, a tornam uma alternativa muito atraente para o fechamento da parede abdominal em pacientes com múltiplas reintervenções28 e, no início, um melhor estado vascular.
A resistência e a integração nos tecidos dos diferentes tipos de transplante de parede abdominal são impressionantes, mostrando que essas técnicas são alternativas muito sólidas de fechamento da parede, especialmente no caso de reoperações. Em séries publicadas,22 elas demonstram uma força significativa, com uma notável falta de aderências dos intestinos ao enxerto de parede.16 Em nossa série com enxertos não vascularizados, a presença de fibrose macroscópica na necropsia de um paciente e em exames de imagem do outro demonstrou boa integração sem a necessidade de suporte vascular.
Novas classificações, como a proposta por Light et al. 29 poderiam ser úteis no planejamento pré-operatório das necessidades de enxertos, bem como para poder comparar os diferentes enxertos além de seu suporte vascular.
O fato de os transplantes multiviscerais e intestinais representarem um percentual muito baixo do total influencia o menor uso do transplante de parede abdominal e provavelmente tem limitado muito sua difusão. Entretanto, a possibilidade de utilização deste tipo de enxerto em receptores de transplante hepático com paredes abdominais hostis poderia estender a indicação. Isto é especialmente verdadeiro dada a incidência de complicações com a malha de polipropileno (e o fato da malha não poder entrar em contato com as vísceras) e os maus resultados com a malha de politetrafluoroetileno expandido em termos de reoperação e infecção. As alternativas com malha biológica usadas em nosso hospital30 só apresentaram resultados aceitáveis em receptores pediátricos com pequenos defeitos de parede, e a um custo econômico muito alto, razão pela qual não são mais usadas em receptores adultos.
O uso de tal transplante sem transplantes associados de outras vísceras parece pelo menos controverso dadas as necessidades de imunossupressão, e as alternativas com malha e compostos são mais viáveis em pacientes não imunossuprimidos.
Conclusão
Os transplantes de parede abdominal são uma alternativa válida em pacientes submetidos a transplante com lesão prévia da parede abdominal (impedindo a reparação devido à perda de camadas musculares) ou tamanhos inadequados do doador/enxerto com a necessidade de redução do enxerto.
Conflito de Interesses
Os autores não têm conflito de interesses a declarar.