Definiția Brønsted-Lowry a acidității și bazicității
Vom începe discuția noastră despre chimia acido-bazică cu câteva definiții esențiale. Prima dintre acestea a fost propusă în 1923 de către chimistul danez Johannes Brønsted și chimistul englez Thomas Lowry și a ajuns să fie cunoscută sub numele de definiția Brønsted-Lowry a acidității și bazicității. Conform definiției Brønsted-Lowry, un acid este o specie care acționează ca un donator de protoni, în timp ce o bază este un acceptor de protoni. Am discutat deja în capitolul anterior unul dintre cele mai cunoscute exemple de reacție acido-bazică Brønsted-Lowry, între acidul clorhidric și ionul hidroxid:
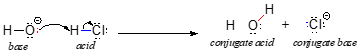
În această reacție, un proton este transferat de la HCl (acidul, sau donatorul de protoni) la ionul hidroxid (baza, sau acceptorul de protoni). Așa cum am învățat în capitolul anterior, săgețile curbe descriu mișcarea electronilor în acest proces de rupere și formare a legăturilor.
După ce un acid Brønsted-Lowry donează un proton, ceea ce rămâne se numește bază conjugată. Astfel, ionul clorură este baza conjugată a acidului clorhidric. Invers, atunci când o bază Brønsted-Lowry acceptă un proton, aceasta se transformă în forma sa conjugată de acid: apa este astfel acidul conjugat al ionului hidroxid.
Iată o reacție acido-bazică organică, între acidul acetic și metilamina:
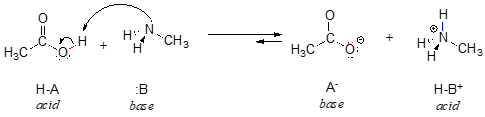
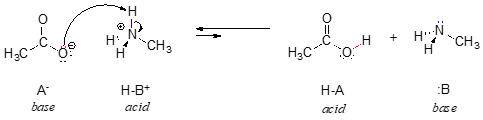
În reversul acestei reacții, ionul acetat este baza, iar ionul metilamoniu (metilamina protonată) este acidul.
Ce face ca un compus să fie acid (susceptibil să doneze un proton) sau bazic (susceptibil să accepte un proton)? Răspunsul la această întrebare este una dintre principalele noastre sarcini în acest capitol și ne va cere să folosim o mare parte din ceea ce am învățat despre structura organică în primele două capitole, precum și ideile despre termodinamică pe care le-am analizat în capitolul 6.
Pentru moment, să luăm în considerare doar o proprietate comună a bazelor: pentru a acționa ca o bază, o moleculă trebuie să aibă o pereche reactivă de electroni. În toate reacțiile acido-bazice pe care le vom vedea în acest capitol, specia bazică are un atom cu o pereche solitară de electroni. Atunci când metilamina acționează ca bază, de exemplu, perechea singuratică de electroni de pe atomul de azot este folosită pentru a forma o nouă legătură cu un proton.
Evident, ionul de metilamoniu nu poate acționa ca o bază – nu are o pereche reactivă de electroni cu care să accepte un proton.
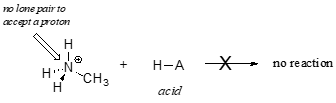
Mai târziu, în capitolul 14, vom studia reacțiile în care o pereche de electroni dintr-o legătură a unei alchene sau a unui inel aromatic acționează în mod bazic – dar, deocamdată, ne vom concentra asupra bazicității electronilor nelegatari (pereche solitară).
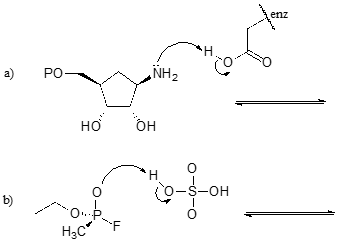
Exercițiu \(\PageIndex{1}\)
Completați reacțiile de mai jos – cu alte cuvinte, desenați structurile pentru acizii conjugați și bazele conjugate lipsă care rezultă din săgețile curbe furnizate.