Definirea constantei de aciditate
Sunteți, fără îndoială, conștienți de faptul că unii acizi sunt mai puternici decât alții. Aciditatea relativă a diferiților compuși sau grupuri funcționale – cu alte cuvinte, capacitatea lor relativă de a dona un proton unei baze comune în condiții identice – este cuantificată printr-un număr numit constanta de aciditate, prescurtat \(K_a\). Baza comună aleasă pentru comparație este apa.
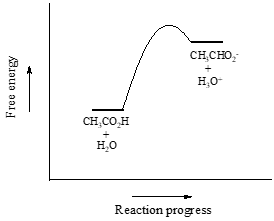
Vom considera acidul acetic ca fiind primul nostru exemplu. Dacă facem o soluție diluată de acid acetic în apă, are loc o reacție acido-bazică între acid (donator de protoni) și apă (acceptor de protoni).

Acidul acetic este un acid slab, astfel încât echilibrul favorizează reactivii față de produși – este termodinamic „în urcare”. Acest lucru este indicat în figura de mai sus prin lungimea relativă a săgeților de reacție înainte și înapoi.
Constanta de echilibru \(K_{eq}\) se definește astfel:
\}{}{} = \frac{}{}\}]
Amintiți-vă că aceasta este o soluție apoasă diluată: am adăugat o cantitate mică de acid acetic la o cantitate mare de apă. Prin urmare, în cursul reacției, concentrația de apă (aproximativ 55,6 mol/L) se modifică foarte puțin și poate fi tratată ca o constantă.
Dacă mutăm termenul constant pentru concentrația de apă în partea stângă a expresiei constantei de echilibru, obținem expresia pentru \(K_a\), constanta acidului pentru acidul acetic:
\ = \frac{}{}\\]
În termeni mai generali, constanta de disociere pentru un anumit acid HA sau HB+ se exprimă astfel:
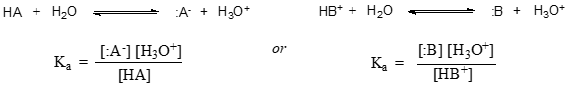
Valoarea lui \(K_a\) pentru acidul acetic este \(1.75 \ de ori 10^{-5}\) – mult mai mică decât \(1\), ceea ce indică faptul că există mult mai mult acid acetic în soluție la echilibru decât acetat și ioni de hidroniu.
În schimb, acidul sulfuric, cu un \(K_a\) de aproximativ \(10^9\), sau acidul clorhidric, cu un \(K_a\) de aproximativ \(10^7\), ambele suferă o disociere practic completă în apă: sunt acizi foarte puternici.
Un număr ca \(1,75 \ ori 10^{- 5}\) nu este foarte ușor nici de pronunțat, nici de reținut, nici de vizualizat, așa că chimiștii folosesc de obicei un termen mai convenabil pentru a exprima aciditatea relativă. Valoarea \(pK_a\) a unui acid este pur și simplu log (baza 10) a valorii sale \(K_a\).
\
Făcând calculele, aflăm că valoarea \(pK_a\) a acidului acetic este \(4,8\). Valoarea \(pK_a\) a acidului sulfuric este -10, iar a acidului clorhidric este -7. Utilizarea valorilor \(pK_a\) ne permite să exprimăm aciditatea relativă a compușilor și grupurilor funcționale comune pe o scară numerică de la aproximativ -10 (pentru un acid foarte puternic) la 50 (pentru un compus care nu este deloc acid). Cu cât valoarea \(pK_a\) este mai mică, cu atât acidul este mai puternic.
Grupurile funcționale ionizabile (care donează sau acceptă protoni) relevante pentru chimia organică biologică au, în general, valori \(pK_a\) cuprinse între aproximativ 5 și aproximativ 20. Cele mai importante dintre acestea sunt rezumate mai jos, cu valori \(pK_a\) foarte aproximative pentru formele de acid conjugat. Mai multe grupuri acide cu valori \(pK_a\) apropiate de zero sunt, de asemenea, incluse ca referință.
Valorile \(pK_a\) tipice
| grupa | aproximative ale \(pK_a\) | |
|---|---|---|
| Ion de hidroniu | 0 | |
| alcool protonat | 0 | |
| carbonil protonat | 0 | 0 |
| acizi carboxilici | 5 | |
| imine protonate | 7 | |
| amine protonate | 10 | |
| fenoli | 10 | |
| thioli | 10 | |
| alcooli, apă | 15 | |
| acizi carbonați | 20 |
* * acizi carbonați
*\(\alpha\)-carbonați vor fi explicați în secțiunea 7.6A
Este foarte recomandat să memorați acum aceste valori aproximative – apoi, dacă aveți nevoie de o valoare mai precisă, puteți oricând să o căutați într-un tabel \(pK_a\) mai complet. Apendicele la această carte conține un tabel mai detaliat al valorilor tipice \(pK_a\), iar tabele mult mai complete sunt disponibile în resurse precum Handbook of Chemistry and Physics.
\(pK_a\) vs. \(pK_a\). \(pH\)
Este important să realizăm că \(pK_a\) nu este același lucru cu \(pH\): primul este o proprietate inerentă a unui compus sau a unui grup funcțional, în timp ce al doilea este o măsură a concentrației ionilor de hidroniu într-o anumită soluție apoasă:
Cunoașterea valorilor \(pK_a\) nu numai că ne permite să comparăm tăria acizilor, dar ne permite și să comparăm tăria bazelor. Ideea cheie de reținut este următoarea: cu cât acidul conjugat este mai puternic, cu atât baza conjugată este mai slabă. Putem determina că ionul de hidroxid este o bază mai puternică decât amoniacul (\(NH_3\)), deoarece ionul de amoniu (\(NH4^+\), \(pK_a = 9.2\\)) este un acid mai puternic decât apa (\(pK_a = 15,7\)).
Exercițiu \(\PageIndex{1}\)
Ce bază este mai puternică, \(CH_3O^-\) sau \(CH_3S^-\)? Ionul acetat sau amoniacul? Ionul hidroxid sau ionul acetat?
Să punem în practică înțelegerea noastră a conceptului \(pK_a\) în contextul unei molecule mai complexe. De exemplu, care este \(pK_a\) compusului de mai jos?

Trebuie să evaluăm aciditatea potențială a patru tipuri diferite de protoni de pe moleculă și să îl găsim pe cel mai acid. Protonii aromatici nu sunt toți acizi – \(pK_a\) lor este de aproximativ 45. Grupa amină nu este, de asemenea, acidă, \(pK_a\) fiind de aproximativ 35. (Amintiți-vă că aminele neîncărcate sunt bazice: aminele protonate încărcate pozitiv, cu valori \(pK_a\) în jur de 10, sunt slab acide). Protonul alcoolului are o valoare \(pK_a\) de aproximativ 15, iar protonul fenolului are o valoare \(pK_a\) de aproximativ 10: astfel, cea mai acidă grupare de pe molecula de mai sus este fenolul. (Asigurați-vă că puteți recunoaște diferența dintre un fenol și un alcool – nu uitați că, într-un fenol, grupa \(OH\) este legată direct de inelul aromatic). Dacă această moleculă ar reacționa cu un echivalent molar al unei baze puternice, cum ar fi hidroxidul de sodiu, protonul fenolului este cel care ar fi donat pentru a forma un anion fenolat.
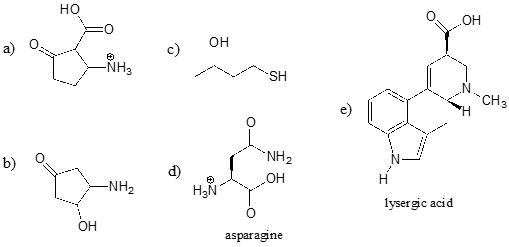
Exercițiu \(\PageIndex{2}\)
Identificați grupa funcțională cea mai acidă de pe fiecare dintre moleculele de mai jos și precizați valoarea aproximativă a \(pK_a\) acesteia.