| Ed Davis, Ph.D. |
Introducere
Lentivirusul și virusul adeno-asociat (AAV) s-au dovedit a fi de neprețuit pentru introducerea de material genetic în celulele mamiferelor, fie în cultură, fie în animale întregi. Ambele sisteme se pretează foarte bine la multe aplicații de cercetare de bază, cum ar fi supraexprimarea proteinelor, producția de anticorpi și knock-out-ul genelor, și ambele sunt promițătoare pentru terapia genică. Cu toate acestea, fiecare sistem viral are avantajele și dezavantajele sale unice, în funcție de aplicație. GeneCopoeia oferă linii de produse extinse atât pentru lentivirus, cât și pentru AAV, oferindu-vă opțiuni puternice și flexibile pentru livrarea ADN-ului în celule. În această notă tehnică, descriem tehnologiile care stau la baza liniilor de produse GeneCopoeia Lentifect™ lentivirus și AAVPrime™ AAV și discutăm meritele fiecărei tehnologii pentru diferite aplicații, pentru a vă ajuta să alegeți care sistem se potrivește cel mai bine nevoilor dumneavoastră.
De ce să folosiți viruși pentru livrarea ADN?
Una dintre cele mai comune modalități de livrare a ADN-ului în celule este prin transfecția pe bază de plasmidă, în care celulele sunt tratate cu compuși chimici, cum ar fi fosfatul de calciu, sau cu reactivi pe bază de lipide. Cu toate acestea, transfecția cu plasmidă nu este întotdeauna de dorit sau practică. De exemplu, unele celule sunt foarte greu sau imposibil de transfectat, în timp ce majoritatea celulelor cultivate suportă infecția (cunoscută și sub numele de transducție) fie prin lentivirus, fie prin AAV. În al doilea rând, transfecția plasmidică nu poate fi utilizată pentru livrarea de ADN in vivo, dar transducția virală poate fi utilizată. Atât lentivirusul, cât și AAV pot fi utilizate pentru o multitudine de aplicații, cum ar fi expresia proteinelor din cadrele de lectură deschise (ORF), eliminarea genelor prin interferență ARN (RNAi) mediată de ARN cu fir de păr scurt (shRNA), luciferaza și alte teste cu gene reporter, precum și eliminarea genelor mediată de sistemul clustered, regularly-interspaced, short palindromic repeats-Cas9 (CRISPR-Cas9). Multe dintre aceste aplicații pentru vectorii virali au fost realizate cu succes în linii de celule de mamifere imortalizate în cultură, în culturi de celule primare, în modele animale și în terapia genică pe pacienți umani.
Termenul „Lentivirus” se referă la clasa de retrovirusuri care include virusul imunodeficienței umane (HIV) și, de fapt, majoritatea sistemelor lentivirale utilizate în prezent sunt derivate din HIV (analizat în Mátrai, et al, 2010; Sakuma, et al., 2012). Lentivirusurile purtătoare de transgene se integrează în genom în momentul infecției, permițând astfel o expresie stabilă atât în celulele care se divid, cât și în cele care nu se divid.
Sistemele lentivirale au fost puternic modificate de la HIV de-a lungul mai multor generații pentru a le face sigure la manipulare și utile pentru aplicații. GeneCopoeia utilizează a treia generație de sisteme lentivirale (Dull, et al. 1998), care necesită patru plasmide separate pentru a produce particule virale infecțioase (virioni). Un plasmid lentiviral GeneCopoeia poartă doar gena de interes (GOI) care urmează să fie exprimată, o genă de selecție a antibioticelor și secvențele de semnal de ambalare. Uneori, clona va include, de asemenea, o genă reporter fluorescentă. Plasmidul care conține GOI, cu markerul selectabil și gena reporter, poate găzdui inserții de până la aproximativ 5-6 kb. (figura 1), deși titrurile virale scad dramatic atunci când dimensiunile inserțiilor depășesc aproximativ 4 kb.
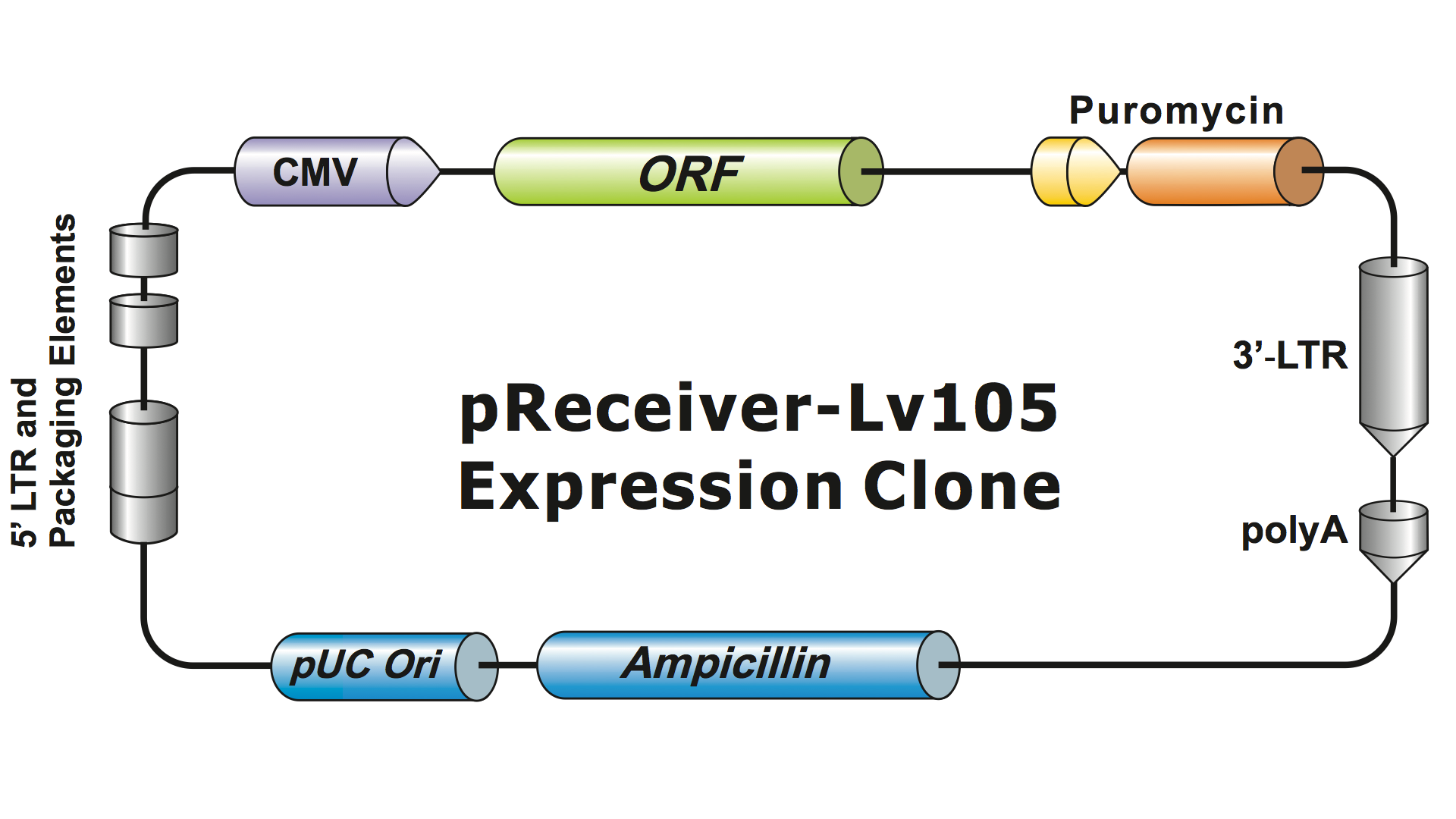 |
Figura 1. Exemplu de clonă de expresie lentivirală GeneCopoeia |
Plasmidele suplimentare exprimă elementele retrovirale necesare pentru împachetare și integrare (gag, pol, env, Rev). Atunci când toate cele patru plasmide sunt exprimate în celulele de ambalare, ARN-ul GOI este încorporat în particule. Deoarece proteinele retrovirale sunt exprimate numai în timpul împachetării, celulele infectate nu pot produce un virus infecțios. În plus, particulele lentivirale Lentifect™ de la GeneCopoeia conțin o deleție în regiunea U3 a LTR-urilor, ceea ce le face să fie autoinactivate (SIN). Deleția SIN împiedică replicarea lentivirală în cazul rar în care toate cele patru plasmide se recombină pentru a crea o singură plasmidă virală activă. Prin urmare, particulele lentivirale pot fi manipulate în condiții de siguranță, practic nu există nicio șansă de a genera virusuri patogene.
În plus față de modificările de siguranță îmbunătățite, particulele lentivirale Lentifect™ de la GeneCopoeia poartă glicoproteina virusului stomatitei veziculare G (VSV-G) în locul genei env a virusului HIV de tip sălbatic, ceea ce schimbă tropismul tisular al virusului de la celulele T CD4+ la aproape orice tip de celule de mamifere. Ca atare, lentivirusurile sunt un sistem utilizat pe scară largă pentru cultura de celule de mamifere, modele animale și aplicații de terapie genică.
Pentru că vectorii lentivirali au fost modificați în aceste moduri, sistemele lentivirale Lentifect™ de la GeneCopoeia au o siguranță sporită și au următoarele caracteristici care le fac foarte utile pentru livrarea de ADN:
- Infectă aproape toate tipurile de celule de mamifere
- Pot fi utilizate pentru a livra secvențe de ADN relativ mari – până la aproximativ 5-6 kb în lungime
- Pot fi utilizate pentru a genera linii celulare stabile sau pentru a determina expresia stabilă a genelor în organe și țesuturi in vivo, datorită integrării transgenei în locații aleatorii în genom
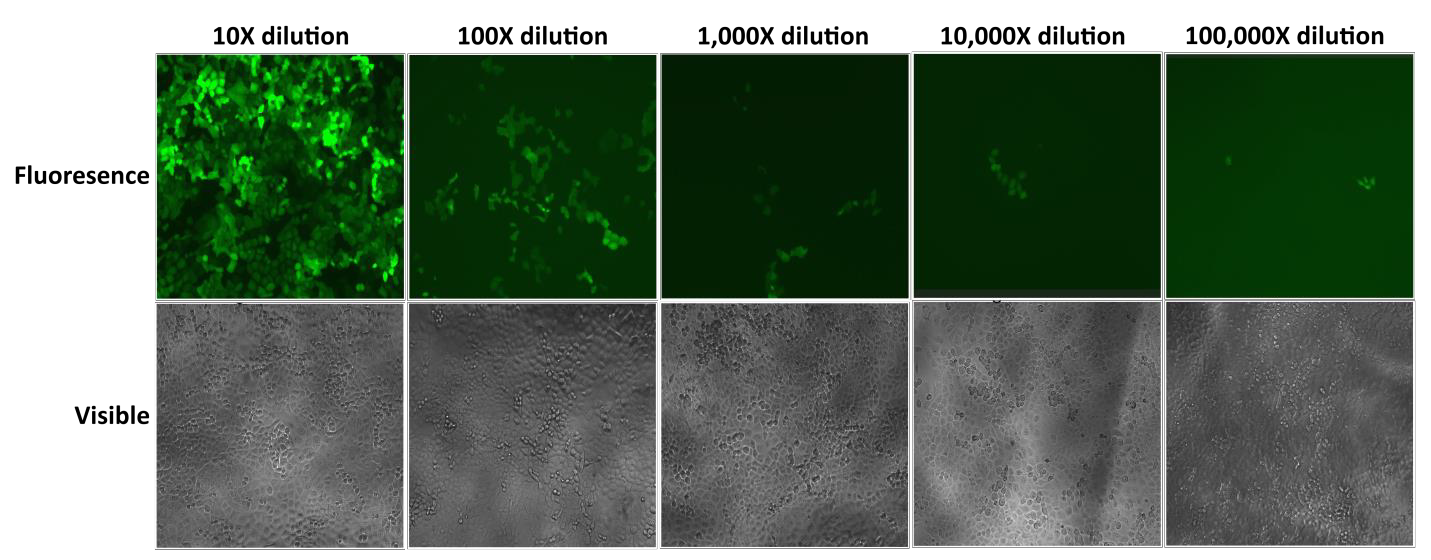
Părticulele lentivirale Lentifect™ de la GeneCopoeia oferă titruri ridicate, permițând cercetătorilor să exprime eficient genele de interes (figura 2).
|
Figura 2. Testarea diluțiilor seriale de particule lentivirale Lentifect™. fluorescența eGFP a fost fotografiată cu un microscop cu fluorescență la 72 de ore după transducție. |
|
GeneCopoeia oferă una dintre cele mai extinse linii de produse lentivirale din industrie (tabelul 1).
| Produs/serviciu | Descriere |
| Clone lentivirale și vectori de clonare | Clone pre-fabricate și personalizate care transportă ORF-uri, promotori, ARNhc, ARNm 3′ UTR-uri miRNA, precursori și inhibitori, ARNg și multe altele. Disponibile cu mai mulți promotori, etichete și reporteri. Vectori pentru clonarea „do-it-yourself” a secvențelor de interes. |
| Părticule lentivirale Lentifect™ | Părticule lentivirale pre-fabricate și ambalate la comandă, gata de utilizare. Produse din colecțiile extinse de clone GeneCopoeia, la nivelul întregului genom, sau din clonele trimise de clienți. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Sistem complet de reactivi pentru producția de particule lentivirale „do-it-yourself”. Include plasmide de împachetare, linie celulară de împachetare, soluție de concentrare a particulelor și kit de titrare. |
Tabel 1. Linia de produse și servicii lentivirale de la GeneCopoeia.
Sisteme bazate pe AAV
În contrast cu genomul ARN al lentivirusurilor, AAV are un genom ADN monocatenar (Samulski și Muzyczka, 2014). De asemenea, AAV nu este derivat dintr-un agent patogen; mai degrabă este un contaminant al adenovirusului, fără să i se atribuie condiții patogene. AAV care apare în mod natural se integrează în genom ca și lentivirusul, dar numai la nivelul locusului AAVS1 de pe cromozomul 19. Acest loc este, de asemenea, cunoscut sub numele de „Safe Harbor”, deoarece este utilizat în mod obișnuit pentru inserția transgenei fără a afecta celulele (DeKelver, et al., 2010).
Ca și lentivirusul, AAV a fost modificat pentru siguranță și utilizabilitate. AAV necesită o coinfecție cu un virus ajutător. Genomul AAV are o lungime de 4,7 kb și conține 2 gene, Rep și Cap, care sunt necesare pentru replicarea și integrarea virală. În AAVPrime™, Rep și Cap sunt eliminate, lăsând doar repetările terminale inversate (ITR) 5′ și 3′ de 145 bp. Eliminarea Rep și Cap are trei scopuri: 1) elimină capacitatea unui virus auxiliar de a permite celulelor infectate cu AAV să producă noi virioni AAV; 2) permite inserția de gene cu o lungime de până la aproximativ 4 kb (deși titrul viral scade în cazul transgenelor mai lungi de 3 kb); și 3) elimină practic capacitatea de integrare a AAV. Dimensiunile mici ale AAV reprezintă o provocare pentru anumite aplicații. De exemplu, pentru editarea genomului CRISPR, cercetătorii folosesc nucleaza Cas9 din S. aureus, deoarece este cu aproximativ 30% mai scurtă decât Cas9 din S. pyogenes, mai frecvent utilizată (Ran, et al., 2015).
Pentru împachetare, Rep și Cap au fost mutate pe o plasmidă diferită, iar genele de ajutor ale Adenovirusului sunt plasmate pe o a treia plasmidă, ceea ce face ca întregul sistem de împachetare să fie sigur și fără virus de ajutor (Figura 3).
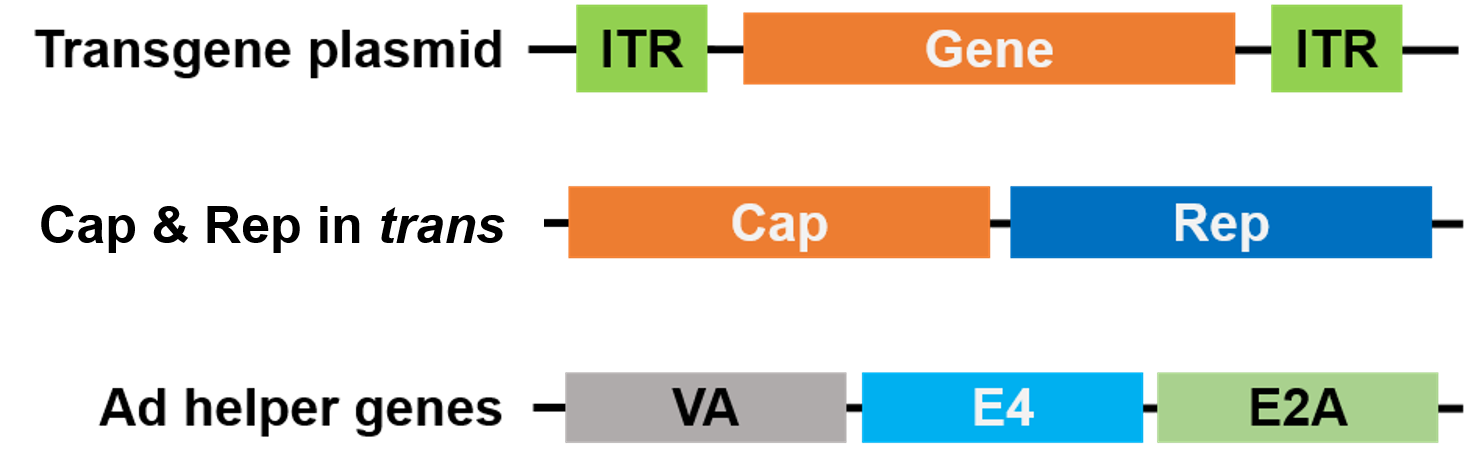 |
Figura 3. AAV fără virus ajutător. Pentru împachetare se utilizează 3 plasmide. Plasmidul cu gena de interes (sus) conține repetările terminale inversate (ITR). O a 2-a plasmidă (mijloc) poartă genele AAV Cap și Rep, iar a 3-a plasmidă (jos) poartă genele necesare de la Adenovirus (Ad) |
În plus, AAV există în serotipuri diferite, care afectează specificitatea tisulară a infecției AAV. Serotipurile multiple permit cercetătorilor fie a) să infecteze o gamă largă de celule gazdă; fie b) să limiteze infecția la unul sau la câteva țesuturi. Particulele AAV AAV AAVPrime™ de la GeneCopoeia sunt disponibile în mai multe serotipuri (tabelul 2).
| Serotip | Tesut țintă principal | Descriere |
| AAV-1 | Musculare | Cel mai bun pentru mușchiul cardiac, mușchiul scheletic, țesut neuronal și glial. |
| AAV-2 | Muscul, ficat, retină | Serotipul cel mai frecvent utilizat. Cel mai bun pentru neuroni, mușchi, ficat și creier. |
| AAV-3 | Megakaryocytes | Cel mai bun pentru megakaryocytes, mușchi, ficat, plămâni și retină. |
| AAV-4 | Retina | Cel mai bun pentru neuroni, mușchi, creier și retină. |
| AAV-5 | Lung | Cel mai bun pentru plămâni, neuroni, articulație sinovială, retină și pancreas. |
| AAV-6 | Muschi, plămâni | Cel mai bun pentru plămâni, ficat și inimă. |
| AAV-7 | Mușchi, retină, neuroni | Cel mai bun pentru mușchi, neuroni și ficat. |
| AAV-8 | Feat | Cel mai bun pentru mușchi, creier, ficat și retină. |
| AAV-9 | Variante | Cel mai bun pentru mușchi, inimă, ficat, plămâni și creier. |
| AAV-10 | Pleura, CNS | Clonat din Cynomolgus, aproape identic cu AAVrh10 cu excepția a 12 aminoacizi în VP1. Cel mai bun pentru plămâni, mușchi, inimă, NCS și ficat. |
| AAV-DJ | Variante | Un amestec de 8 serotipuri care apar în mod natural. Transduce în mod eficient o mare varietate de tipuri de celule in vitro. |
| AAV-DJ/8 | Various | O variantă de AAV-DJ cu o mutație a domeniului de legare a heparinei (HBD), care permite infectarea ficatului, precum și a altor țesuturi in vivo. |
Tabel 2. Lista serotipurilor AAV utilizate pe scară largă
Particulele AAV AAVPrime™ au următoarele caracteristici care le fac foarte utile pentru livrarea de ADN:
- Titluri ridicate. Titrul particulelor purificate poate fi de până la 10^14 GC/ml (copii de genom/ml)
- Versatilitate. Serotipurile multiple permit utilizarea într-o gamă largă sau limitată de celule gazdă
- Toxicitate scăzută. Nu se integrează în genomul gazdei.
- Imunogenitate scăzută. Răspuns imunitar minim al gazdei.
- Siguranță. Nu este asociat cu nicio boală umană
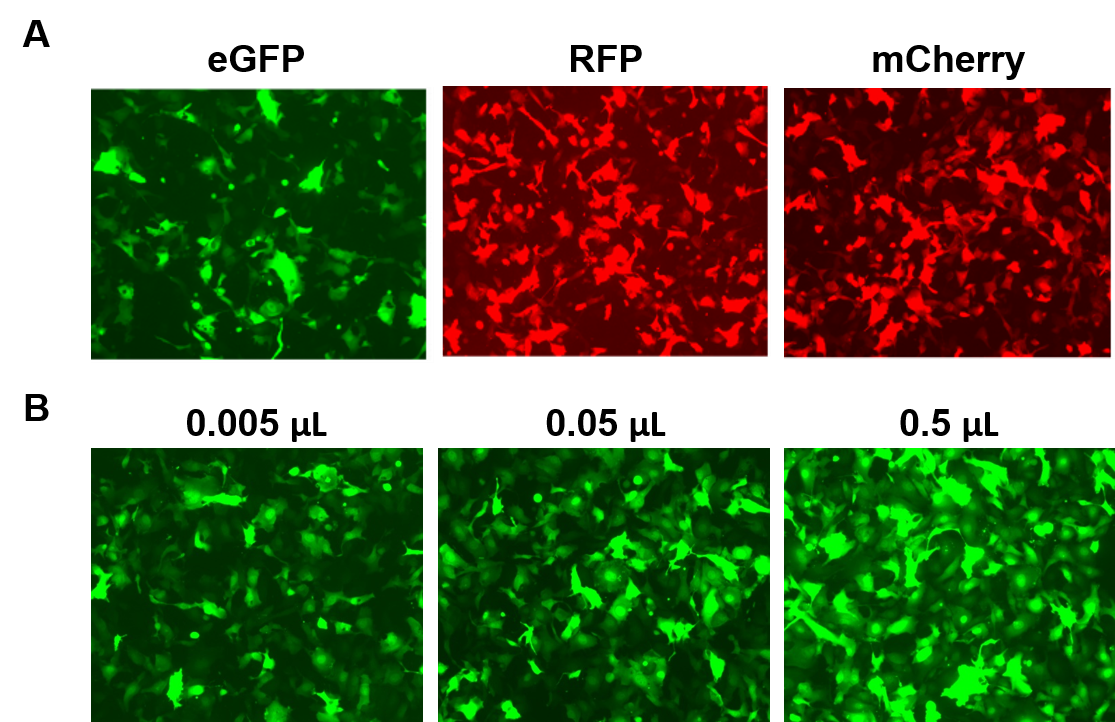
Particulele AAVPrime™ sunt disponibile pentru ORF-uri umane și de șoarece de până la 3 kb, în mai multe serotipuri și opțiuni de promotori, fie în puritate standard (numai pentru utilizare in vitro), fie purificate (pentru utilizare in vivo). Clienții pot comanda clone de plasmidă, particule generate la comandă pentru genele de interes sau pot alege dintre opțiunile prefabricate care exprimă gene cum ar fi reportoarele fluorescente (figura 4).
|
Figura 4. Performanța particulelor AAVPrime™ de la GeneCopoeia. A. Celule HT1080 în plăci cu 24 de puțuri transduși cu 0,5 µL de AAV de puritate standard care exprimă GFP îmbunătățită (eGFP), proteină fluorescentă roșie (RFP) și Cherry monomerică (mCherry). B. Celulele HT1080 în plăci cu 24 de godeuri au fost transduși cu cantități variabile de AAV purificat care exprimă eGFP. Celulele au fost vizualizate cu un microscop cu fluorescență (Timp de expunere: 400 ms). |
|
Ce ar trebui să aleg: Lentivirus sau AAV?
Alegerea între lentivirus și AAV depinde de mulți factori. De exemplu, faptul că lentivirusurile se integrează în genom poate fi atât un avantaj, cât și un dezavantaj, în funcție de nevoile dumneavoastră. Consultați tabelul de mai jos pentru a vă ajuta să vă decideți:
| Inserții mai mari | Integrare stabilă | Nu. integrare | Specificitate celulară/tehnologică | siguranță in vivo | ||
| Lentivirus | ✔︎ | ✔︎ | ||||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Pentru a afla mai multe despre sistemele virale GeneCopoeia și pentru a comanda, vizitați site-ul nostru (https://www.genecopoeia.com/product/lentiviral-system/)
Concluzii
La GeneCopoeia, ne străduim să vă oferim cea mai înaltă calitate, tehnologie de ultimă oră în materie de produse pentru genomică funcțională și biologie celulară. Oferim o gamă largă de produse, de la seturi de clone de ADN plasmidic la nivelul întregului genom pentru ORF-uri, promotori de gene, miARN-uri, ARNhc și CRISPR, la kituri și reactivi puternici, până la produse pentru sonde fluorescente de structură celulară, cuantificare a acizilor nucleici și anticorpi marcați. Pentru a afla mai multe, vă rugăm să vizitați site-ul nostru, www.genecopoeia.com, sau să ne contactați la [email protected].
DeKelver, et al. (2010). Analiza genomică funcțională, proteomică și de reglementare a ADN-ului în medii izogenice utilizând transgeneza condusă de nucleaze cu degete de zinc într-un locus de adăpost sigur în genomul uman. Genome Res 20, 1133.
Dull, et al. (1998). A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72, 8463.
Ran, et al. (2015). Editarea genomului in vivo utilizând Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Vectorii lentivirali: de la bază la translațional. Biochem. J. 443, 603.
Samulski și Muzyczka (2014). Terapia genică mediată de AAV pentru scopuri de cercetare și terapeutice. Annu. Rev. Virol. 1, 427.