Datorită simplității structurale relative și repetitivității ADN-ului, ar rezulta că proteinele care se leagă în mod specific de acesta ar putea avea motive comune ale domeniului de legare a ADN-ului, dar cu lanțuri laterale specifice de aminoacizi care să permită interacțiuni de legare specifice.
- helix-turn-helix: se găsește în proteinele procariote de legare a ADN-ului.
Figura: helix-turn-helix
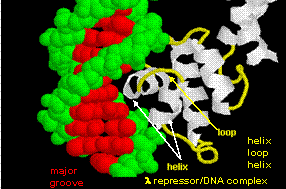
Figura prezintă două astfel de proteine, represorul cro de la bacteriofagul 434 și represorul lambda de la bacteriofagul lambda. (Bacteriofagele sunt virusuri care infectează bacteriile.) Observați cum specificitatea este obținută, în parte, prin formarea de legături H specifice între proteină și canelura majoră a ADN-ului operator.
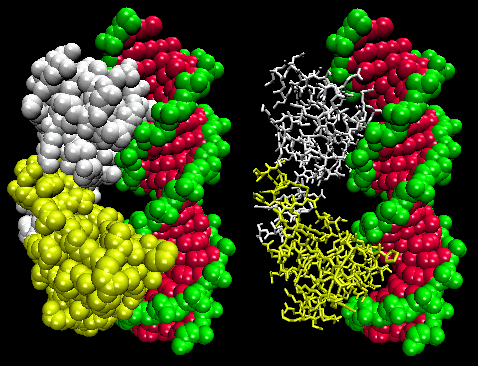
Figura: Complexul Represor Lambda/ADN
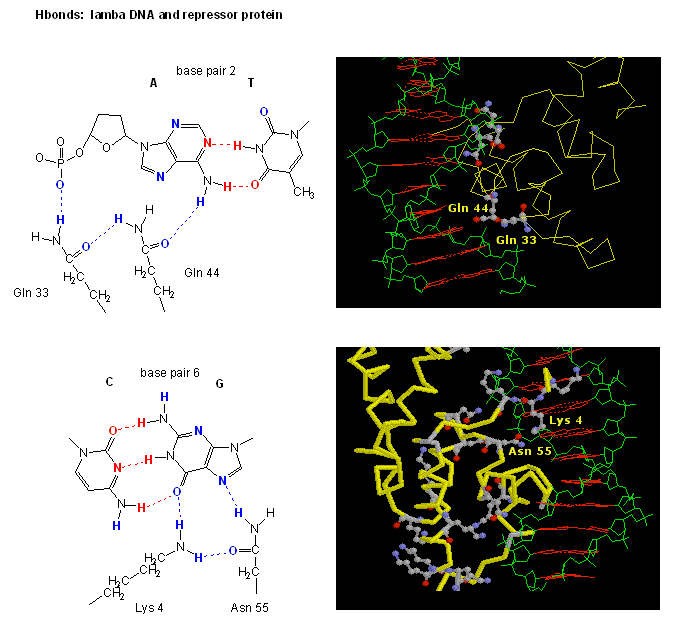
Figură: Interacțiunile de legătură H între reprimatorulλ și ADN
![]() Jmol: Complexul represor Lambda/ADN actualizat Jmol14 (Java) | JSMol (HTML5)
Jmol: Complexul represor Lambda/ADN actualizat Jmol14 (Java) | JSMol (HTML5)
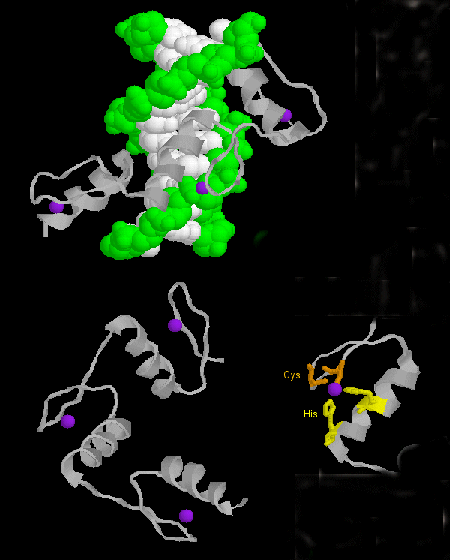
- degetul de zinc: (eucariote) Aceste proteine au un motiv comun de secvență X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4- în care X este orice aminoacid. Zn2+ este coordonat tetraedric cu lanțurile laterale Cys și His, care se află pe unul dintre cele două lanțuri beta antiparalele și, respectiv, pe un helix alfa. Degetul de zinc, stabilizat de zinc, se leagă de șanțul principal al ADN-ului. ]
Figura: Degetul de zinc
![]() Jmol: Actualizat Zif268:Complexul ADN Jmol14 (Java) | JSMol (HTML5)
Jmol: Actualizat Zif268:Complexul ADN Jmol14 (Java) | JSMol (HTML5)
Proteinele cu deget de zinc, dintre care 900 sunt codificate în genomul uman (inclusiv proteina eucariotă de legare a izolatorilor CTCF descrisă mai sus) pot fi mobilizate pentru a repara efectiv mutații specifice în celule, ceea ce, dacă se realizează într-un procent suficient de mare de celule mutante, ar putea vindeca boli genetice specifice, cum ar fi unele forme de imunodeficiență combinată severă. În această nouă tehnică (Urnov et al, 2005), mai multe domenii de legare a degetului Zn legate între ele (unul dintre cele naturale sau forme mutante produse în laborator), fiecare dintre acestea fiind specific pentru o anumită secvență de nucleotide, este legat de o endonuclează nespecifică, derivată din enzima FokI. Nucleaza este activă în formă dimerică, astfel încât complexul activ necesită două domenii de endonuclează, fiecare legat de patru domenii diferite de tip Zn finger, pentru a se asambla la locul țintă. Specificitatea legăturii se realizează prin selectarea de către domeniile Zn finger. O crestătură este apoi făcută pe ADN de către nuclează, iar mecanismele de reparare ale celulei gazdă urmează. Acest proces implică separarea catenei, recombinarea omoloagă a regiunii crestate cu ADN complementar în interiorul celulei și repararea crestăturii. Dacă un exces de ADN de tip sălbatic (nemutat) este adăugat în celule și utilizat ca șablon, mutația normală de reparare a ADN-ului ar repara mutația. Urnov et al. au demonstrat că până la 20% din celulele cultivate care conțin o mutație pot fi reparate în laborator. Dacă aceste celule obțin un avantaj de creștere selectivă, celulele mutante ar fi în cele din urmă înlocuite cu celule de tip sălbatic.
- receptorii hormonali steroidieni: (eucariote) Spre deosebire de majoritatea hormonilor, care se leagă de receptorii de la suprafața celulară, hormonii steroidieni (derivați ai colesterolului) trec prin membrana celulară și se leagă de receptorii citoplasmatici prin intermediul unui domeniu de legare a hormonilor. Acest lucru modifică forma receptorului, care se leagă apoi de un loc specific de pe ADN (element de răspuns hormonal) prin intermediul unui domeniu de legare la ADN. Într-o structură analogă cu cea a degetului de zinc, Zn 2+ este coordonat tetraedric la 4 Cys, într-o structură de tip globular care se leagă sub formă de dimer la două secvențe identice, dar inversate, de ADN (palindrom) în cadrul șanțului principal. (Exemple de palindromuri: Able am fost înainte de a vedea Elba; Dennis și Edna iau cina, am spus eu, în timp ce Enid și Edna au păcătuit.
Considerați receptorul glucocorticoid (GR) ca un exemplu specific. Acesta se leagă de ADN sub forma unui dimer. Cele două domenii de legare la ADN ale dimerului se asociază cu două caneluri majore adiacente ale ADN-ului din secvența de legare a GR (GR binding sequence – GBS), o scurtă secvență de ADN din cadrul promotorului. Meijsing, et al. au descoperit că nu numai că GBS acționează ca un situs de legare pentru GR, permițând transcrierea genelor, dar afectează, de asemenea, conformația receptorului, făcând ca transcrierea genelor să fie reglată într-un alt mod. Grupul a construit „gene reportoare” de luciferază, care au GBS legat de gena pentru proteina luciferază, care ar exprima proteina luciferază (care este fluorescentă) dacă ar fi transcrise, cu GBS. Aceștia au constatat că activitatea transcripțională relativă nu a fost corelată cu afinitatea relativă de legare a GR la GBS. GBS-urile care erau mult mai active decât altele se legau în mod comparabil cu cele cu activitate mai scăzută, în timp ce GBS-urile cu activitate transcripțională similară se legau cu afinități diferite. Acest lucru arată că GBS conferă o funcție unică GR-ului asociat cu acesta (adică transcrierea nu este pur și simplu afectată de faptul că GR-ul este sau nu legat de GBS). S-a constatat că un „braț de pârghie” al receptorului suferă modificări conformaționale atunci când este legat de ADN, cu modificări specifice secvenței la care a fost legat. O proteină mutantă, GR-γ, a fost făcută să fie identică cu proteina de tip sălbatic, GR-α, cu excepția brațului de pârghie, s-a constatat că avea o activitate transcripțională diferită, chiar dacă se legau la același situs de pe ADN, ceea ce arată că brațul de pârghie și conformația sa afectează transcripția.
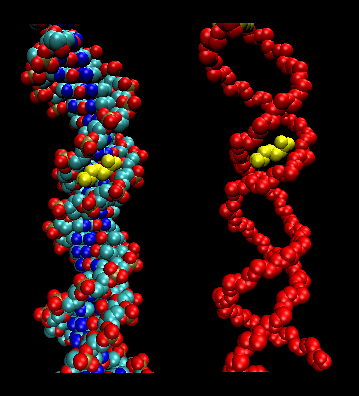
- Zipere (sau foarfeci) de leucină: (eucariote) Aceste proteine conțin porțiuni de 35 de aminoacizi în care Leu se găsește în mod repetat la intervale de 7 aminoacizi. Aceste regiuni ale proteinei formează elice amfifilice, cu Leu pe o față, un Leu după două spire ale unei elice. Două dintre aceste proteine pot forma un dimer, stabilizat prin legarea între ele a acestor elice amfifile nepolare, bogate în leucină, formând o spirală spiralată, la fel ca în cazul proteinei musculare miozina. Fermoarul de leucină reprezintă domeniul de legare a proteinei. Domeniul de legare a ADN-ului se găsește în primii 30 de aminoacizi N-terminali, care sunt bazici și formează o alfa-helix atunci când proteina se leagă de ADN. Fermoarul de leucină funcționează apoi pentru a aduce împreună două proteine de legare a ADN-ului, permițând elicelor bazice N-terminale să interacționeze cu canelura majoră a ADN-ului într-un mod specific bazei. Valina și izoleucina, împreună cu leucina, se găsesc adesea în porțiuni de aminoacizi care pot interacționa pentru a forma alte tipuri de spirale spiralate.
Figura: fermoare de leucină (realizate cu VMD)
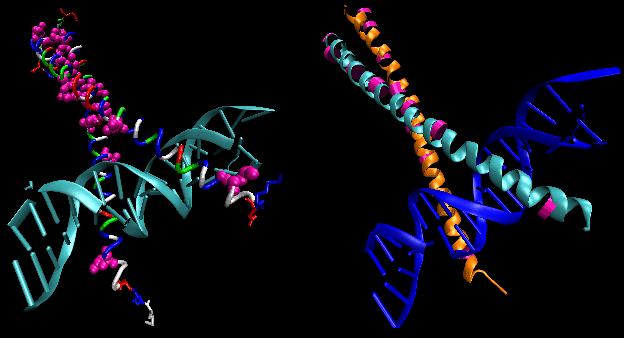
![]() Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
La fel cum nucleazele cu degete de zinc au fost folosite pentru a induce repararea mutațiilor, un alt studiu asupra genomului șobolanului a folosit ZFN-uri special concepute pentru a provoca rupturi în ADN-DS care conțin mutații din mecanismul de reparare a ADN-ului inexact (prin NHEJ) și, prin urmare, conțineau mutații specifice (Geurts, et al. 2009). Acest proces, �knockout al genei,� împiedică producerea proteinei transcrise în mod normal de către gena țintă. Au fost utilizate ZFN-uri cu cinci și șase degete pentru a obține un nivel ridicat de specificitate în legarea la gena vizată pentru trei proteine diferite: proteina fluorescentă verde (GFP), imunoglobulina M (IgM) și Rab38. Eliminarea a avut succes la 12% dintre șobolanii testați; aceste animale nu au avut nicio proteină de tip sălbatic și nu au avut nicio expresie. ZFN-urile au fost suficient de specifice încât nu au fost observate mutații la niciunul dintre cele 20 de situri prezise ca nefiind vizate. Acest studiu susține viabilitatea controlului transcripției și expresiei pentru tratamentul bolilor și importanța legăturii specifice.
Am văzut că doi factori principali contribuie la recunoașterea specifică a ADN-ului de către proteine; formarea de legături de hidrogen cu donatori și acceptori nucleotidici specifici în șanțul major și deformările dependente de secvență ale helixului ADN în forme modificate cu afinitate crescută a liganzilor proteici. De exemplu, proteina Tata Binding Protein (TBP) poate interacționa cu un șanț minor lărgit în caseta TATA. Noile descoperiri susțin că, în plus, proteinele sunt capabile să utilizeze informațiile din șanțurile minore care au devenit „îngustate” în funcție de secvența nucleotidelor.
Traseele de ADN îmbogățite în A pot duce la conformații de răsucire care provoacă legături de hidrogen între perechile de baze în șanțurile majore, rezultă în îngustarea șanțurilor minore. Cantități mari de perechi de baze AT sunt concentrate în canelurile minore înguste (lățimea <5,0 �), iar perechile de baze CG se găsesc mai frecvent în canelurile minore largi.
Cum afectează îngustarea canelurilor minore recunoașterea ADN-ului? Canelurile minore înguste sporesc potențialul electrostatic negativ al ADN-ului, făcându-l un situs mai specific și mai ușor de recunoscut. Fosfații din coloana vertebrală a ADN-ului sunt mai aproape de mijlocul șanțului atunci când acesta este îngust, corelând astfel șanțurile minore înguste cu un potențial electrostatic mai negativ.
Părțile proteinelor care interacționează cu canelura minoră conțin arginină, al cărei lanț lateral poate fi acomodat în canelura minoră mai îngustă și mai negativă. Argininele se pot lega și, în unele cazuri, se pot insera ca motive de secvență scurtă care sporesc specificitatea recunoașterii formei ADN. Arg este preferată față de Lys, deoarece razele efective ale încărcăturii din Arg sunt mai mari decât ale purtătorului de sarcină din Lys. Acest lucru ar conduce la o energie de desolvare mai mică pentru Arg, ceea ce ar favoriza legarea sa la canelura majoră îngustată. Această descoperire arată că „rolul formei ADN-ului trebuie luat în considerare la adnotarea întregului genom și la predicția situsurilor de legare a factorilor de transcripție”.
Figura: Arg în legarea T3c Transposase în crângul minor îngustat al transpozonului T3c
- Model de alunecare pentru interacțiunile proteină/ADN
Contribuitori și atribuții
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)