- Introducere
- Materiale și metode
- Materiale și produse chimice
- Pregătirea liniei celulare
- Prepararea peștilor zebră
- Cell Viability Assay and Morphological Observation
- Analiza apoptozei prin colorare DAPI și citometrie în flux
- Sesizare pe animale cu xenogrefe
- Analiză PCR în timp real (qPCR)
- Analiză Western Blot (WB)
- Analiză statistică
- Rezultate
- Efectul antiproliferativ al TF
- Efectul pro-apoptotic al TF
- Efectul in vivo al TF asupra Xenograftului Zebrafishes
- Acțiunea moleculară a TF asupra expresiilor ARNm în celulele A375
- Acțiunea moleculară a TB asupra expresiei proteinelor în celulele A375
- Discuție
- Concluzie
- Declarație privind disponibilitatea datelor
- Declarație de etică
- Contribuții ale autorilor
- Finanțare
- Conflict de interese
- Abbreviații
Introducere
Melanomul este un tip fatal de cancer de piele, cu un potențial metastatic ridicat și intratabilitate (Yang et al., 2018). Pacienții cu melanom în stadii avansate sunt întotdeauna nerezecabili și au un prognostic mai prost (Leonardi et al., 2018). Chimioterapia este un pilon de bază al tratamentului clinic pentru melanom, dar eficacitatea chimioterapiei este limitată din cauza efectelor secundare pe care le au asupra țesuturilor sănătoase (Oliveira Pinho et al., 2019). Recent, au fost dezvoltate mai multe imunoterapii, inclusiv inhibitori ai receptorilor CTLA-4 sau PD-1, ca noi opțiuni pentru tratarea melanomului, dar eficacitatea acestora nu este fiabilă, iar efectele lor secundare sunt încă neneglijabile (Rodríguez-Cerdeira et al., 2017). Prin urmare, este nevoie urgentă de noi strategii cu eficacitate și siguranță satisfăcătoare. Medicina tradițională chineză (MTC) este o abordare complementară și a fost aplicată clinic de mii de ani, posedând o anumită eficacitate și mai puține efecte secundare. Conform teoriei MTC, cancerul este asociat cu acumularea în organism de flegmă, toxine sau inflamații, iar plantele anti-flegmă, antitoxice sau antiinflamatorii pot poseda efecte anticancerigene (Wang și Cheng, 2019). Teoria a fost susținută de multe cazuri. De exemplu, curcumina din Rhizoma Curcumae longae a exercitat efecte citotoxice prin inducerea apoptozei și inhibarea angiogenezei celulelor de melanom (Mirzaei et al., 2016), iar vitexina din Vitex negundo a suprimat creșterea celulelor de melanom prin inducerea de leziuni ale ADN-ului și creșterea nivelului de ROS (Liu et al., 2018). Prin urmare, componentele pe bază de plante TCM au un mare potențial pentru tratamentul cancerelor, cum ar fi melanomul.
Teiul este una dintre cele mai răspândite băuturi din lume. Este bine cunoscut nu numai pentru aroma deosebită, ci și pentru beneficiile pentru sănătate. Datorită diferenței de proces, ceaiul are trei tipuri principale, inclusiv ceaiul verde nefermentat, ceaiul oolong parțial fermentat și ceaiul negru complet fermentat sau ceaiul pu-erh (Kuo et al., 2005). Frunzele de ceai au fost caracterizate ca fiind o plantă TCM cu proprietăți antiflegmice și antitoxice, ceea ce indică potențialul său anticancerigen. Studiile moderne au raportat că băutura de ceai este eficientă în prevenirea și tratarea cancerelor (Jin et al., 2018). Recent, s-a constatat că polifenolii din ceai posedă activitate anticancerigenă, care au un efect superior băuturii de ceai (Mao et al., 2019). Teaflavina (TF) este o astfel de componentă polifenolică produsă prin oxidarea catechinelor din frunzele de ceai în timpul fermentării, acționând ca un pigment principal pentru culoarea, aroma și bioactivitatea ceaiului (Roberts et al., 1957). Este capabil să inducă apoptoza într-o varietate de linii celulare canceroase, cum ar fi liniile celulare de carcinom mamar uman (MCF-7, MDA-MB-231, T47D și ZR-75-1), liniile celulare de carcinom de colon (HCT-15 și HT-29) și liniile celulare de carcinom hepatic (HCCLM3 și Huh-7), indicând un potențial anticancerigen (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Cu toate acestea, până în prezent, s-a acordat puțină atenție efectului său față de melanom.
Având în vedere efectele pro-apoptotice raportate ale TF asupra multor linii celulare canceroase (Lahiry et al., 2008), am înaintat o ipoteză conform căreia TF exercită efecte pro-apoptotice asupra celulelor de melanom. Pentru a verifica acest lucru, în prezenta lucrare s-au efectuat experimente in vitro pentru a evalua efectul proapoptotic citotoxic al TF asupra celulelor de melanom uman și s-a efectuat un experiment in vivo prin utilizarea unui model de xenogrefă în larve de pește zebră pentru a determina efectul său de inhibare a tumorii. Mai mult, mecanismul TF a fost, de asemenea, explorat.
Materiale și metode
Materiale și produse chimice
Teaflavina (TF, >95% de puritate) a fost furnizată de Theabio Co., Ltd (Hangzhou, China) (număr de lot: 20181211061). Mediul Dulbecco′s modified Eagle′s medium (DMEM) cu conținut ridicat de glucoză (4,5 g/l) a fost obținut de la HyClone Laboratories (UT, SUA). Serul fetal de bovine (FBS) a fost obținut de la Cell Max (Beijing, China). Tripsina (0,25%) a fost obținută de la Gibco (NY, SUA). Bromura de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazoliu (MTT) și dimetilsulfoxid (DMSO) au fost obținute de la Sigma (St. Louis, MO, SUA). Annexin-V: FITC kit de detectare a apoptozei a fost obținut de la BD Biosciences (CA, SUA). Soluția de colorare cu 4′-6-diamidino-2-fenilindol (DAPI) a fost obținută de la Thermo Fisher Scientific (MA, SUA). Anticorpii primari au fost obținuți de la Cell Signaling Technology (MA, SUA). Reactivul Trizol și kitul de reacție în lanț a polimerazei în timp real (PCR în timp real) au fost obținute de la TaKaRa (Dalian, China).
Pregătirea liniei celulare
Fibroblastele cutanate umane HFF-1 și linia celulară de melanom A375 au fost obținute de la Shanghai Cell Bank of Chinese Academy of Sciences (Shanghai, China), iar linia celulară de melanom uman A875 a fost obținută de la Kunming Cell Bank of Chinese Academy of Sciences (Kunming, China). Aceste linii celulare au fost cultivate în mediu DMEM conținând 10% FBS la 37°C într-un incubator umidificat cu 5% CO2. Mediul a fost schimbat zilnic, iar celulele au fost tratate cu TF în faza lor de creștere logaritmică.
Prepararea peștilor zebră
Steaua AB de tip sălbatic de pești zebră a fost obținută de la China Zebrafish Resource Center, Institute of Hydrobiology, China Academy of Science (Wuhan, China) și a fost acreditată de Association for Assessment and Accreditation of Laboratory Animal Care International (SYXK 2012-0171). Larvele de pești zebră la 2 dpf (zile după fertilizare) au fost produse prin împerechere naturală pe perechi și au fost adăpostite într-o instalație de acvacultură cu lumină controlată, cu o fotoperioadă standard de 14:10 h zi/noapte, și hrănite cu creveți de saramură vii de două ori pe zi și cu fulgi de pește praștie o dată pe zi.
Cell Viability Assay and Morphological Observation
S-au efectuat teste de viabilitate celulară și observare morfologică
S-au efectuat teste de MT pentru a determina efectele inhibitoare ale TF asupra liniilor celulare de melanom, așa cum s-a descris anterior (Zhou et al., 2017). Celulele au fost însămânțate în plăci cu 96 de puțuri la 6×103 celule/puț în 200 μl de mediu pentru o aderență de 24 de ore, urmate de tratamentul cu TF la concentrații de 0, 50, 100, 150, 200, 250, 300 și 400 μg/ml timp de 24, 48 și 72 h. Apoi, în fiecare puț s-au adăugat 20 μl de soluție de MTT (5,0 mg/ml) și s-au incubat la 37°C timp de 4h. DMSO (150 μl) a fost adăugat în fiecare gode și valoarea densității optice (valoarea OD) a fost măsurată la 490 nm cu cititorul de microplăci Biorad (CA, SUA). Rata de inhibiție (%) = × 100%. Concentrațiile inhibitorii de 50% (IC50) pentru 24, 48 și 72 h au fost calculate prin analiză de regresie. În consecință, 120, 240 și 360 μg/ml (232,3, 464,7 și 697,0 μM) au fost desemnate ca doze mici, medii și mari de TF. Apoi, liniile celulare HFF-1, A375 și A875 au fost însămânțate în plăci cu 96 de puțuri ca mai sus și au fost tratate cu doza medie de TF la 24 h. Morfologia celulară a celulelor A375 a fost observată la microscopul cu fluorescență Carl Zeiss (Göttingen, Germania).
Analiza apoptozei prin colorare DAPI și citometrie în flux
Apoptoza celulară a fost determinată prin colorare DAPI și citometrie în flux bazată pe colorarea cu anexină-V/PI. Pentru colorarea DAPI, celulele A375 au fost însămânțate în plăci cu 96 de puțuri și tratate cu TF la concentrații scăzute, medii și ridicate timp de 24 h, urmate de fixarea cu paraformaldehidă 4% în PBS timp de 30 min la temperatura camerei și colorarea cu DAPI timp de 10 min la întuneric. După spălare de trei ori, celulele au fost observate cu ajutorul a cinci lamboane de acoperire la microscopul cu fluorescență Carl Zeiss (Göttingen, Germania) și au fost numărate celulele apoptotice. Citometria în flux a fost efectuată în conformitate cu instrucțiunile producătorului. Pe scurt, celulele A375 au fost însămânțate în plăci cu 6 puțuri la 3×105 celule/puț timp de 24 h și au fost tratate cu TF la concentrații scăzute, medii și ridicate timp de încă 48 h. Ulterior, celulele au fost spălate de două ori și marcate cu soluție de izotiocianat de fluoresceină anexină V și PI în tampon de legare. Intensitatea fluorescenței celulelor a fost detectată prin citometrie de flux BD C6 (CA, SUA). Analiza a fost repetată și s-au calculat ratele de celule apoptotice timpurii și apoptotice târzii (%).
Sesizare pe animale cu xenogrefe
Pentru determinarea intervalului de doze de TF, s-au folosit în total 300 de larve de pește zebră la 3 dpf și au fost cultivate aleatoriu în plăci cu 6 godeuri cu câte 30 de pești. TF au fost dizolvate în fiecare puț la 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1.000 și, respectiv, 2.000 μg/ml, timp de 24 h. Ulterior, peștii din fiecare grup au fost observați la microscopul stereoscopic pentru a înregistra mortalitatea și evenimentele adverse. Așa cum a fost descris în studiul nostru anterior, a fost estimat nivelul fără efecte adverse observate (NOAEL) al TF, iar 1/9 NOAEL, 1/3 NOAEL și NOAEL au fost aplicate ca doze mici, medii și mari pentru următorul experiment (Jin et al., 2018).
Pentru a stabili modelul de xenogrefă, celulele A375 au fost colorate cu CM-Dil (fluorescență roșie) la o diluție de 1:1.000 și microinjectate în sacul vitelinic al larvelor de pești zebră (2 dpf) la o doză de 200 de celule/pește. După creșterea tumorii timp de 24 h, toți peștii au fost observați la un microscop fluorescent (AZ100, Nikon, Tokyo, Japonia) pentru verificarea modelului. Peștii purtători de A375 au fost grupați în 5 grupuri (30 de pești fiecare) și au fost tratați cu 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL și NOAEL de TF, precum și, respectiv, 15 μg/ml (50 μM) de cisplatin, timp de 24 h. Intensitatea fluorescenței (FI) a masei de celule A375 a peștilor zebră a fost detectată, iar rata de inhibiție a fost calculată astfel: rata de inhibiție (%) = × 100%.
Analiză PCR în timp real (qPCR)
Pentru a evidenția acțiunile moleculare ale TF asupra celulelor A375, s-a utilizat qPCR pe un sistem ABI QuantStudio™ 7 Flex Real-Time PCR (Applied Biosystems, CA, SUA). ARN-ul total al celulelor A375 a fost extras cu ajutorul reactivului Trizol și sintetizat în ADNc prin transcriere inversă. Sistemul de reacție qPCR a avut un volum de 20,0 μl: 10 μl de SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl de amorsă PCR înainte, 0,8 μl de amorsă PCR inversă, 2,0 μl de ADNc șablon, 0,4 μl de colorant de referință ROX și 6,0 μl de ddH2O. Condiția de reacție qPCR a fost setată la 95°C pentru 30 de secunde de denaturare inițială, 40 de cicluri de 95°C pentru 5 secunde de denaturare, 60°C pentru 34 de secunde de recoacere și 72°C pentru 40 de secunde de prelungire. La sfârșitul fiecărei reacții, s-a efectuat o analiză a curbei de topire. β-ACTIN a fost utilizată ca genă de referință și s-a aplicat metoda 2-ΔΔCT pentru a analiza expresia relativă a fiecărei gene (tabelul 1).

Tabel 1 Secvențe de primer utilizate pentru analiza qPCR.
Analiză Western Blot (WB)
Expresia proteică a celulelor A375 cu tratament cu TF la 0 μg/ml și 120 μg/ml (232,3 μM) a fost analizată prin analiză WB. Proteinele totale au fost extrase cu ajutorul unui tampon de liză (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1% Triton, 0,1% SDS, 5 μg/ml leupeptină și 1 mM PMSF) timp de 30 min la gheață cu congelare și decongelare repetată. Proteinele vizate au fost separate cu ajutorul electroforezei pe gel de poliacrilamidă de dodecil sulfat de sodiu denaturant (SDS-PAGE) (8~12%) și apoi transferate pe o membrană de fluorură de poliviniliden (PVDF) (Millipore, MA, SUA). Membrana a fost blocată cu 5% lapte degresat timp de 2 h, urmată de o incubare peste noapte la 4°C cu anticorpi împotriva: ACTIN, ASK1, ATM, ATM fosforilat (p-ATM), ATR, ATR fosforilat (p-ATR), caspaza scindată 3 (c-CASP3), caspaza scindată 8 (c-CASP8), CHK1, CHK2, CHK1 și CHK2 fosforilate (p-CHK1 și p-CHK2), JNK, JNK fosforilat (p-JNK), C-JUN, C-JUN fosforilat (p-C-JUN), PARP (poli ADP-riboză polimeraza), P53 și P53 fosforilat (p-P53). După incubarea cu anticorpul secundar, aceste proteine au fost vizualizate cu un kit de chemiluminescență îmbunătățită (Amersham Pharmacia Biotech, Little Chalfort, UK) și detectate cu ajutorul unui analizor de chemiluminescență.
Analiză statistică
Datele au fost exprimate ca valori medii ± SD și au fost supuse ANOVA într-o singură direcție, urmată de compararea cu cea mai mică diferență semnificativă (LSD) a lui Fisher. Toate analizele au fost efectuate utilizând o versiune actualizată a software-ului DPS (Tang și Zhang, 2013).
Rezultate
Efectul antiproliferativ al TF
Cum se arată în figura 1A, TF la 50 μg/ml (96.8 μM) a inhibat semnificativ viabilitatea celulelor A375, iar ratele de inhibiție au crescut odată cu creșterea concentrațiilor de TF de la 50 la 400 μg/ml (96,8 până la 744,4 μM) (fiecare P < 0,01 față de nivelul normal), ceea ce indică o manieră dependentă de concentrație. Ratele de inhibiție au crescut, de asemenea, odată cu tratamentul cu TF de la 24 la 72 h, cu IC50 de la 218,9 la 84,9 μg/ml (423,8 la 164,4 μM), respectiv. Apoi, am aplicat 120, 240 și 360 μg/ml (232,3, 464,7 și 697,0 μM) ca doze de TF-L, TF-M și, respectiv, TF-H. După cum se arată în figura 1B, TF-M a inhibat în mod evident viabilitatea celulelor A375 și A875, dar a exercitat un efect redus asupra celulelor HFF-1. După cum se arată în figura 1C, morfologia celulelor A375 a fost în mod evident alterată, iar numărul de celule vii a scăzut odată cu tratamentul cu TF la concentrații din ce în ce mai mari.

Figura 1 Viabilitatea celulară a celulelor A375 cu tratament cu TF la 24, 48 și 72 de ore (A), viabilitatea celulară a celulelor HFF-1, A375 și A875 cu tratament cu TF la 24 de ore (B) și morfologia celulelor A375 cu tratament cu teaflavină (TF) la 24 de ore (C). Datele au reprezentat media ± SD (n = 5). Prin intermediul comparațiilor multiple cu cea mai mică diferență semnificativă (LSD) a lui Fisher, datele (medie ± SD) cu aceeași literă minusculă (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d) nu indică nicio diferență semnificativă între ele, în timp ce datele cu litere diferite (a vs. b vs. c vs. b vs. b vs. e vs. f vs. g) indică diferențe semnificative între ele. Bară de scară = 200 μm.
Efectul pro-apoptotic al TF
S-a efectuat colorarea DAPI și citometria în flux pentru a evalua efectul pro-apoptotic al TF asupra celulelor A375. Rezultatul colorației DAPI a arătat o morfologie apoptotică, inclusiv o formă micșorată, cariopicnoză și fragmentare nucleară, în celulele A375 cu tratament cu TF de la 120 la 360 μg/ml (232,3 la 697,0 μM) (figura 2A) (figura 2A). Numărul de celule apoptotice a crescut semnificativ cu tratamentul cu TF la 240 și 360 μg/ml (464,7 și 697,0 μM) (fiecare P < 0,01 față de NC) (Figura 2C) (Figura 2C). Rezultatul citometriei de flux a arătat apoptoza timpurie indusă de TB și apoptoza târzie a celulelor A375 (Figura 2B). Numărul de celule apoptotice timpurii și târzii a crescut cu tratamentul cu TF de la 120 la 360 μg/ml (232,3 la 697,0 μM) (Figura 2B), iar proporțiile lor au fost semnificativ mai mari cu tratamentul cu TF la 360 μg/ml (697,0 μM) (P < 0,01 și P < 0,05 față de nivelul normal) (Figurile 2D, E). Rezultatele au indicat că TF a indus apoptoza celulelor A375 într-o manieră dependentă de concentrație.
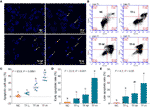
Figura 2 Observarea colorării DAPI (A) și analiza prin citometrie de flux (B) pe celulele A375 cu tratament cu teaflavină (TF). Analiza statistică a ratei celulelor apoptotice (C), analiza statistică a ratei apoptotice timpurii (D) și analiza statistică a ratei apoptotice târzii (E). Prin intermediul comparațiilor multiple de tip Fisher’s least significant difference (LSD), datele (medie ± SD) cu aceeași literă minusculă (a vs. ab; ab vs. b; b vs. b; c vs. c) nu indică o diferență semnificativă între ele, în timp ce datele cu litere diferite (a vs. b vs. c) indică o diferență semnificativă între ele. Bară de scară = 100 μm.
Efectul in vivo al TF asupra Xenograftului Zebrafishes
Curbele mortalității și ale evenimentelor adverse ale Zebrafishes cu tratament cu TF au fost prezentate în Fig. 3A. Moartea peștilor a fost cauzată de TF la 31,25 μg/ml (60,5 μM) și niciun pește nu a supraviețuit cu TF la 125 μg/ml (242,0 μM), ceea ce indică faptul că doza maximă neletală de TF este mai mică de 31,25 μg/ml (60,5 μM). Evenimentele adverse, inclusiv rostogolirea anormală a corpului și edemul, au fost observate cu tratamentul cu TF de la 3,47 μg/ml (6,7 μM) până la dozele sale mai mari, indicând NOAEL de TF mai mic de 3,47 μg/ml (6,7 μM). După repetarea testelor, NOAEL a fost estimat în cele din urmă la 2,0 μg/ml (3,9 μM). Astfel, 0,22, 0,67 și 2,0 μg/ml (0,4, 1,3 și 3,9 μM) au fost utilizate ca doze scăzute, medii și ridicate de TF pentru experimentul ulterior.
Așa cum se arată în figura 3B, a fost stabilit un model de xenogrefă de celule A375 în larve de pește zebră și au fost testate intensitățile fluorescente ale masei celulare din pești. După 24 h de tratament, TF de la 0,22 la 2,0 μg/ml (0,4, 1,3 și 3,9 μM) a inhibat în mod evident creșterea tumorii A375, cu rate de inhibiție de la 1,0 la 46,4 %. Efectele inhibitorii ale TF la 0,67 și 2,0 μg/ml (1,3 și 3,9 μM) au fost semnificative, în comparație cu grupul model (P < 0,01), iar efectul TF la 2,0 μg/ml (3,9 μM) a fost chiar mai mare decât cel al cisplatinului la NOAEL (50 μM).
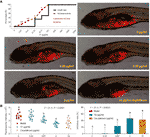
Figura 3 Mortalitatea și efectele adverse ale larvelor de zebră induse de theaflavin (TF) și observarea larvelor de zebră xenotransplantate cu celule A375 cu tratament cu TF sau cisplatin (A), precum și intensitatea fluorescenței și ratele de inhibare a TF (B). Zona fluorescentă în roșu reprezintă masa de celule A375. Prin intermediul comparațiilor multiple LSD, datele (medie ± SD) cu aceeași literă minusculă (a vs. a; c vs. c) nu indică nicio diferență semnificativă între ele, în timp ce datele cu litere diferite (a vs. b vs. c) indică diferențe semnificative între ele.
Acțiunea moleculară a TF asupra expresiilor ARNm în celulele A375
Expresiile relative ale ARNm ale genelor vizate de TF au fost testate prin testul qPCR. După cum se arată în Fig. 4, expresiile BAX, BIM, C-MYC, P21, P53 și PUMA au fost reglementate în mod semnificativ de TF (fiecare P < 0,01 față de nivelul NC), cu excepția celei a BAX în cazul tratamentului cu TF la concentrația sa scăzută. Deși expresia BCL-2 a fost crescută de TF, raportul BAX/BCL-2 a fost semnificativ mai mare în cazul tratamentului cu TF la concentrații medii și mari decât la nivelul NC (P < 0,01), ceea ce indică rolul major al BAX în acțiunea TF.
Acțiunea moleculară a TB asupra expresiei proteinelor în celulele A375
WB a fost aplicat pentru a determina expresia și fosforilarea proteinelor vizate de TF. După cum se arată în figura 5, expresiile de ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8 și c-CASP3 au fost semnificativ reglate de TF la 120 μg/ml (232,3 μM) (fiecare P < 0,01 față de nivelul NC). În plus, acțiunile TF asupra ATR, p-ATR, CHK2, P53, C-JUN (43 kd) și p-C-JUN (Ser 73) au fost nesemnificative (fiecare P > 0,05 față de nivelul NC).
Discuție
Deși activitățile anticancerigene ale TF au fost bine documentate (Sur și Panda, 2017; Takemoto și Takemoto, 2018; Sajadimajd et al, 2020), cunoștințele privind eficacitatea sa asupra melanomului sunt încă puține. Pentru a umple această lacună, prezentul studiu a efectuat experimente in vitro și in vivo pentru a studia efectele și mecanismul TF împotriva celulelor de melanom. Pentru prima dată, am demonstrat efectele citotoxice pro-apoptotice și inhibitorii tumorale ale TF asupra celulelor de melanom A375. Mecanismul său a fost sugerat a fi asociat cu căile P53 și JNK. Inovația acestui studiu este constatarea eficacității TF′s anti-melanom, în timp ce rapoartele anterioare s-au concentrat doar pe efectele TF′s asupra altor tumori (Lin, 2002; Sur și Panda, 2017). În plus, acesta este, de asemenea, primul raport privind acțiunea moleculară a TF asupra căii JNK, în timp ce mecanismul asociat căii P53 a efectului pro-apoptotic al TF asupra celulelor de carcinom a fost raportat anterior (Lahiry et al., 2008).
În ultima vreme, modelele tumorale xenograft care utilizează larve de pește zebră au atras o atenție tot mai mare pentru studiile anticancer, datorită avantajelor pe care le prezintă larvele de pește zebră în comparație cu alte modele animale: (1) lipsa respingerii imune împotriva celulelor umane asigură o rată de succes mai mare pentru xenotransplant; (2) transparența corpului permite observarea vizibilă in vivo a creșterii tumorilor și a toxicității medicamentelor; și (3) generarea pe scară largă și organogeneza rapidă asigură perioade experimentale mai scurte (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). În acest studiu, TF a exercitat un efect inhibitor dependent de doză asupra masei tumorale A375 în larvele de pește zebră (Figura 3B), cu o rată de inhibare de 46,4% la NOAEL (3,9 μM). Rata de inhibiție a fost mai mare decât cea a cisplatinului, ceea ce indică faptul că TF a fost mai eficient decât cisplatinul în intervalul de doze sigure respective. Mai mult, rata de inhibiție a fost mai mare decât cea a unui alt pigment de ceai (theabrownin) (Jin et al., 2018), sugerând că TF este cea mai eficientă componentă a ceaiului. Cu toate acestea, intervalul de doze eficiente in vivo (de la 1,3 la 3,9 μM) de TF este mult mai mic decât intervalul său de doze eficiente in vitro (de la 96,8 la 774,4 μM). Motivul pentru o astfel de diferență poate fi acela că, după administrarea orală, derivații metabolizați ai TF au un efect mai mare decât cel al TF. Aceasta indică faptul că aplicarea orală poate fi mai eficientă decât alte căi de administrare a TF.
Conform regulii de conversie a dozei, dozele efective (1,3 și 3,9 μM) de TF în larvele de pește zebră pot fi estimate ca fiind între 0,03 și 0,09 mg/kg la om (Zhang et al., 2003). Aceasta sugerează că administrarea orală de TF la un interval de doze atât de mici poate fi eficientă în tratarea pacienților cu melanom, ceea ce indică o bună rentabilitate a acestui compus. Până la cunoștințele noastre, există doar câteva rapoarte privind aplicarea clinică a TF. Un studiu dublu-orb, randomizat, controlat cu placebo, cu grupuri paralele a aplicat extractul de ceai verde îmbogățit cu TF pentru a trata pacienții cu hipercolesterolemie ușoară până la moderată timp de 12 săptămâni (Maron et al., 2003). În cadrul acelui studiu, aportul zilnic de TF a fost de 75 mg în extract de ceai verde, care a redus semnificativ colesterolul total, LDL-C și trigliceridele la adulții hipercolesterolemici, fără observarea unor evenimente adverse semnificative (Maron et al., 2003). În acest studiu, intervalul de doze eficiente de TF a fost mult mai mic decât cel raportat, sugerând un potențial mai mare al TF pentru tratamentul melanomului în clinică. Cu toate acestea, deși intervalul de doze efective de TF a fost mic, pragul dozei sale letale pentru larvele de pește zebră a fost, de asemenea, scăzut (<60,5 μM) și a fost mai mic decât alți pigmenți de ceai (Figura 3A) (Jin et al., 2018), lăsând o îngrijorare cu privire la potențiala toxicitate a TF pentru ființele umane. În mod interesant, am constatat că TF a exercitat un efect redus asupra liniei celulare normale (fibroblast de piele HFF-1) (Figura 1B), sugerând o fezabilitate clinică pentru utilizarea sa externă care poate evita potențiala toxicitate a utilizării sale interne.
Experimentul nostru mecanicist a arătat că TF a activat ATM, CHK1/2, P53, CASP8/3 în calea P53 și, de asemenea, a activat ASK1, JNK și C-JUN în calea JNK, asociindu-se cu apoptoza celulelor A375. Apoptoza a fost determinată prin colorare cu DAPI și analiză citometrică în flux la nivel celular (figura 2) și mediată de supraexprimarea genelor pro-apoptotice (P53, BAX, BIM și PUMA) și de activarea proteinelor legate de apoptoză (caspaze și PARP) la nivel molecular (figurile 4 și 5). P53 (TP53) codifică o fosfoproteină nucleară care se leagă de ADN cu activitate de supresor tumoral, care acționează ca factor de transcripție în centrul unei rețele de control al apoptozei ca răspuns la stresul celular (Martin et al., 2002). Aceasta activează apoptoza prin stimularea transcrierii genelor din familia Bcl-2, cum ar fi BAX, BIM și PUMA (Levine și Oren, 2009). BAX și BIM codifică membri pro-apoptotici care provoacă apoptoza și moartea celulară prin activarea cascadei caspazelor ca răspuns la stimuli apoptotici (Rossé et al., 1998; Youle și Strasser, 2008). PUMA, în calitate de modulator al apoptozei reglat de P53, codifică o proteină care conține un domeniu BH3 care se localizează în mitocondrii, interacționează cu Bax și Bak și activează cascada caspazelor prin clivarea CASP3 (Nakano și Vousden, 2001; Letai, 2009). În acest studiu, CASP8 și CASP3 au fost scindate ca răspuns la activarea P53. CASP8 este o caspază de inițiere în cascada apoptotică, care activează CASP3 pentru fragmentarea apoptotică a ADN-ului, ceea ce duce la scindarea ulterioară a PARP (c-PARP) pentru a executa procesul apoptotic (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP este responsabil de repararea ADN-ului și de viabilitatea celulară ca răspuns la stresul exogen (Satoh și Lindahl, 1992). Acesta poate fi scindat de CASP3 și astfel facilitează dezasamblarea celulară în apoptoză (Oliver et al., 1998). Astfel, cantitatea de PARP scindat (c-PARP) poate fi utilizată ca marker al apoptozei celulare.
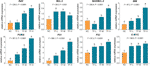
Figura 4 Expresia relativă a ARNm a genelor vizate de theaflavin (TF) în celulele A375 după 24 h de tratament. Prin intermediul comparațiilor multiple de tip Fisher’s least significant difference (LSD), datele (medie ± SD) cu aceeași literă minusculă (a vs. a; b vs. b; c vs. c) indică faptul că nu există diferențe semnificative între ele, în timp ce datele cu litere diferite (a vs. b vs. c vs. d) indică diferențe semnificative între ele.
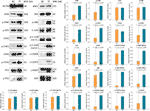
Figura 5 Expresia și fosforilarea proteinelor vizate de teaflavină (TF) în celulele A375 după 24 h de tratament. Datele (medie ± SD) cu litere minuscule diferite sunt semnificativ diferite între ele la comparațiile multiple cu cea mai mică diferență semnificativă (LSD) a lui Fisher.
În studiile noastre anterioare, am raportat că inducerea daunelor ADN a fost asociată cu mecanismul pro-apoptotic mediat de calea P53 al theabrowninei (Wu et al., 2016; Jin et al., 2018). Cu toate acestea, deși atât TF, cât și theabrownin au activat calea P53 și au indus apoptoza celulelor tumorale, în acest studiu nu am constatat inducerea daunelor ADN cu tratamentul TF. În mod alternativ, am constatat activarea cascadei ASK1-JNK-C-JUN, care funcționează, de asemenea, ca o cale apoptotică. În acest modul de semnalizare, ASK1 (kinaza 1 de reglare a semnalului de apoptoză) este o proteină kinază activată de mitogen care joacă un rol-cheie în apoptoza indusă de citokine și de stres prin declanșarea căii dependente de mitocondrie (Matsuzawa și Ichijo, 2001; Zhang et al., 2003). Aceasta activează în aval semnalizarea JNK ca răspuns la diferite tipuri de stres, ceea ce duce la apoptoza celulară prin activarea C-JUN și supraexprimarea ulterioară a genelor pro-apoptotice (Tobiume et al., 2001). S-a raportat că chimioterapicele, cum ar fi cisplatinul, docetaxelul și paclitaxelul, induc apoptoza celulelor de melanom prin intermediul căii JNK independente de calea P53 (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). Acest lucru indică faptul că TF ar putea avea un avantaj în comparație cu aceste medicamente datorită mecanismului său de acțiune mediat de calea dublă, care a fost demonstrat preliminar prin efectele inhibitoare tumorale mai mari ale TF decât cele ale cisplatinului în acest studiu. Cu toate acestea, există unele limitări ale acestui studiu, după cum urmează: (1) nu a fost verificată acțiunea căilor P53 și JNK în mecanismul propus al TF mediat de calea duală; (2) nu a fost investigată interacțiunea dintre căile P53 și JNK și nu se știe care cale joacă rolul principal; și (3) intervalul de doze in vitro și intervalul de doze in vivo sunt destul de diferite, al căror motiv a fost explicat, dar necesită dovezi experimentale. Pentru a aborda aceste probleme, sunt necesare studii suplimentare în viitor. De exemplu, ar trebui utilizate siARN-uri sau inhibitori ai P53 și JNK pentru a verifica acțiunile acestor căi și pentru a explora interacțiunea dintre ele, iar metaboliții serici ai TF ar trebui analizați chimic și studiați farmacologic pentru a testa ipoteza noastră conform căreia derivații metabolizați ai TF au un efect mai mare decât cel al TF. Mai mult, deoarece nu există rapoarte clinice ale TF pentru tratamentul cancerului, eficacitatea terapeutică și beneficiile TF asupra pacienților cu cancer ar trebui să fie studiate în continuare.
Concluzie
Din moment ce potențialul anticancerigen al TF a fost bine documentat, rămâne incert dacă TF este eficient în tratarea melanomului. În acest studiu, prin utilizarea liniei celulare de melanom și a modelului xenograft de pește zebră, am constatat efectele citotoxice pro-apoptotice și inhibitorii tumorale ale TF asupra celulelor de melanom și am dezvăluit mecanismul său în asociere cu activările căilor P53 și JNK. Acesta este primul studiu care descrie efectele și mecanismul TF împotriva celulelor de melanom. Deoarece mecanismul TF nu a fost dependent doar de calea P53, este de așteptat ca TF să fie eficient în tratarea liniilor celulare cu mutație P53. Studii suplimentare sunt justificate pentru a verifica această deducție. În ansamblu, acest studiu oferă dovezi pentru eficacitatea TF împotriva melanomului, ceea ce contribuie la dezvoltarea agenților derivați din TF pentru terapia melanomului.
Declarație privind disponibilitatea datelor
Datele brute care susțin concluziile acestui articol sunt disponibile de la autorul corespondent la o cerere rezonabilă.
Declarație de etică
Studiul pe animale a fost revizuit și aprobat de Comitetul de Etică al Universității Medicale Chineze din Zhejiang.
Contribuții ale autorilor
LeZ a efectuat activitatea principală a acestui articol. BY a efectuat experimentele celulare și moleculare. LiZ și SM au contribuit la redactarea acestui manuscris. WD a furnizat idei și sprijin financiar pentru această lucrare. YX a realizat experimentul cu pește zebră. LS a conceput această lucrare și a redactat manuscrisul. TE a îmbunătățit proiectarea și proiectul acestei lucrări. Toți autorii au contribuit la redactarea articolului și au aprobat versiunea trimisă.
Finanțare
Această lucrare a fost susținută de Fundația Națională de Științe Naturale din China (Grant nr. 81774331, 81873049 și 81973873), Fundația Provincială de Științe Naturale din Zhejiang din China (Grant nr. LY18H270004), Proiectul Provincial de Știință și Tehnologie din Zhejiang al Medicinei Tradiționale Chineze din China (Grant nr. 2016ZZ011), Disciplina Caracteristică de Superioritate a Caracterului Superior al Universității de Construcții Cheie din Zhejiang Provincial (Farmacologie tradițională chineză) și Fundația de Deschidere a Chinei (Grant nr. ZYX2018006).
Conflict de interese
YX a fost angajat de compania Hunter Biotechnology, Inc.
Cei care au rămas declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Abbreviații
DAPI, 4′-6-diamidino-2-fenilindol; DMEM, Dulbecco′s modified Eagle′s medium; DMSO, dimetil sulfoxid; dpf, zile după fertilizare; FBS, ser fetal bovin; FI, intensitatea fluorescenței; LSD, cea mai mică diferență semnificativă a lui Fisher; NOAEL, nivel fără efecte adverse observate; MTT, bromură de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazoliu; PARP, poli ADP-riboză polimerază; SDS-PAGE, electroforeză denaturantă pe gel de poliacrilamidă cu dodecil sulfat de sodiu și sulfat de sodiu; TCM, teaflavină; TF, medicină tradițională chineză.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Theaflavinele întârzie migrația celulelor umane de cancer de sân prin inhibarea NF-kappaB prin intermediul interacțiunii p53-ROS. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A. A., Wang, G., Iyer, S., et al. (1999). Rolul clivajului poli(ADP-riboză) polimerazei (PARP) în apoptoză. Un mutant PARP rezistent la caspaza 3 crește rata de apoptoză în celulele transfectate. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). Caspaza-3 este necesară pentru fragmentarea ADN-ului și modificările morfologice asociate cu apoptoza. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownin declanșează daunele ADN pentru a suprima celulele osteosarcomului uman U2OS prin activarea căii de semnalizare p53. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | Full CrossRef Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebrafish xenografts as a tool for in vivo studies on human cancer. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Studii comparative privind efectele hipolipidemice și efectele supresoare de creștere ale frunzelor de ceai oolong, negru, pu-erh și verde la șobolani. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Contribuția transactivării Bax mediată de p53 în apoptoza celulelor de carcinom epitelial mamar indusă de teaflavin. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Teaflavinele țintesc căile Fas/caspază-8 și Akt/pBad pentru a induce apoptoza în celulele umane de cancer de sân cu mutație p53. Carcinogenesis 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Peștele zebră: un nou model pe podiumul farmaceutic. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Melanomul cutanat: De la patogeneză la terapie (Recenzie). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma lovește Bax. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.200903134
PubMed Abstract | Text integral | Google Scholar
Levine, A. J., Oren, M. (2009). Primii 30 de ani de p53: în creștere tot mai complexă. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | Full CrossRef Text | Google Scholar
Li, B., Vik, S. B., S. B., Tu, Y. (2012). Theaflavinele inhibă ATP-sintetaza și lanțul respirator fără a crește producția de superoxid. J. Nutr. biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Chimioprevenirea cancerului prin polifenoli de ceai prin modularea căilor de transducție a semnalului. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Compusul Vitexin 1, o extracție nouă dintr-o plantă chineză, suprimă creșterea celulelor de melanom prin deteriorarea ADN-ului prin creșterea nivelului de ROS. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatinul induce conformația proapoptotică a lui Bak într-o manieră dependentă de deltaMEKK1. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Ceaiul și componentele sale previn cancerul: O revizuire a mecanismului legat de redox. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Efectul de scădere a colesterolului al unui extract de ceai verde îmbogățit cu teaflavină: un studiu controlat randomizat. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Integrarea datelor privind mutațiile și analiza structurală a proteinei supresoare de tumori TP53. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | Text integral | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Mecanismele moleculare ale deciziei dintre viață și moarte: reglarea apoptozei de către kinaza 1 de reglare a semnalului de apoptoză. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Implicarea stresului reticulului endoplasmatic în apoptoza dependentă de JNK indusă de Docetaxel a melanomului uman. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumin: Un nou candidat pentru terapia melanomului? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, o nouă genă proapoptotică, este indusă de p53. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Strategii nanotehnologice emergente pentru chimioterapia sistemică împotriva melanomului. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Importanța poli(ADP-riboză) polimerazei și a scindării acesteia în apoptoză. Lecție de la un mutant necuprinzător. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). Screening de mare capacitate la vertebrate in vivo. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | Refef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). Substanțele fenolice din ceaiul fabricat. I. Fracționarea și cromatografia pe hârtie a substanțelor solubile în apă. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Progrese în imunoterapia pentru melanom: O analiză cuprinzătoare. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prelungește supraviețuirea celulară după eliberarea indusă de Bax a citocromului c. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Progrese privind polifenolii naturali ca agenți anticancerigeni pentru cancerul de piele. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S. S., Lindahl, T. (1992). Rolul formării de poli(ADP-riboză) în repararea ADN-ului. Nature 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | Refef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Stresul mitocondrial indus de taxol în celulele de melanom este mediat de activarea căilor c-Jun N-terminal kinase (JNK) și p38 prin intermediul proteinei de decuplare 2. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Theaflavinele suprimă creșterea tumorală și metastazele prin blocarea căii STAT3 în carcinomul hepatocelular. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., B. B., Yang, X., et al. (1998). Pro-caspaza-3 este o țintă fiziologică majoră a caspazei-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Aspecte moleculare ale chimioprevenirii cancerului și ale eficacității terapeutice a ceaiului și a polifenolilor de ceai. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Sinteza teaflavinelor și funcțiile lor. Mol. (Basel Elveția) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Software Data Processing System (DPS) cu proiectare experimentală, analiză statistică și extragere de date dezvoltat pentru utilizarea în cercetarea entomologică. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 este necesară pentru activarea susținută a kinazelor MAP JNK/p38 și apoptoză. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analize privind teoria patogenezei toxinei cancerului și teoria „consolidării rezistenței organismului și a eliminării sursei”. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Efectul anti-proliferativ și de inducere a apoptozei al teabrowninei împotriva celulelor de adenocarcinom pulmonar cu celule non-mici A549. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | Refef Full Text | Google Scholar
Yang, K., Fung, T. T. T., Nan, H. (2018). O revizuire epidemiologică a dietei și a melanomului malign cutanat. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). Familia de proteine BCL-2: activități opuse care mediază moartea celulară. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Peștele zebră: un model animal pentru studii toxicologice. Curr. Protoc. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Theabrownin inhibă progresia ciclului celular și creșterea tumorală a carcinomului pulmonar prin mecanismul legat de c-myc. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | Refef Full Text | Google Scholar
.