Introducere
Serotonina (5-hidroxitriptamina, 5-HT) 2C receptori (5-HT2CR) sunt larg răspândiți în creier și mediază efectele reglatoare ale 5-HT asupra anxietății, somnului, secreției hormonale, comportamentului alimentar, activității locomotorii, precum și asupra proceselor de învățare și memorie (Bagdy, 1998; Chagraoui et al., 2016). Disfuncția 5-HT2CR a fost implicată în condiții patologice, cum ar fi anxietatea și depresia (Chagraoui et al., 2016; Di Giovanni și De De Deurwaerdere, 2016). Pe de altă parte, numeroase antidepresive, anxiolitice și antipsihotice au afinități pentru 5-HT2CR, care pot fi implicate în efectele terapeutice ale acestor medicamente (Bagdy et al., 2001; Chagraoui et al., 2016; Di Giovanni și De De Deurwaerdere, 2016). Astfel, 5-HT2CR este o țintă farmacologică promițătoare în tratamentul mai multor tulburări neuropsihiatrice (Chagraoui et al., 2016; Di Giovanni și De De Deurwaerdere, 2016).
S-a descris faptul că stimularea 5-HT2CR produce anxietate și, la rândul său, antagoniștii 5-HT2CR-subtip selectivi, cum ar fi SB-242084, au exercitat efecte anxiolitice marcate (Dekeyne et al., 2000; Bagdy et al., 2001; Kantor et al., 2005). Antagoniștii selectivi 5-HT2CR-antagoniști RS-102221 și SB-242084 au produs efecte de tip antidepresiv cu debut rapid la șoareci (Opal et al., 2014). De asemenea, 5-HT2CR-antagonismul a potențat efectele anxiolitice și antidepresive ale fluoxetinei, un inhibitor selectiv al recaptării serotoninei (SSRI), în plus, a redus efectele secundare motorii la șoareci (Demireva et al., 2018). În mod important, s-a sugerat că interacțiunea sistemelor 5-HT și dopamină (DA) contribuie la aceste efecte (De De Deurwaerdere și Di Giovanni, 2017).
Diferiți parametri de pe electroencefalograma (EEG), atât în timpul stării de veghe, cât și în timpul somnului, au fost descriși pentru a oferi biomarkeri ai depresiei și ai terapiei antidepresive individualizate (Steiger și Kimura, 2010). Oscilațiile gamma sunt componente de frecvență relativ înaltă (>30 Hz) ale EEG, care oferă indicii importante despre dinamica populației neuronale (Buzsaki și Wang, 2012). Oscilațiile gamma au fost asociate cu funcțiile senzoriale și cognitive, precum și cu plasticitatea neuronală și memoria la animale și oameni (Cardin, 2016). Pe de altă parte, activitatea gamma anormală a fost implicată în mai multe afecțiuni psihiatrice (Cardin, 2016). Pe baza numărului tot mai mare de dovezi care sugerează implicarea gamma în patomecanismul depresiei, modificările în oscilațiile gamma au fost propuse recent ca un nou biomarker (sau endofenotip) pentru depresia majoră și chiar pentru urmărirea terapiilor antidepresive (Fitzgerald și Watson, 2018). S-a demonstrat că mai multe antidepresive modifică activitatea gamma (Fitzgerald și Watson, 2018). De exemplu, s-a constatat că SSRI escitalopramul scade puterea gamma în timpul somnului cu mișcare rapidă a ochilor (REMS) în tratamentul acut, în timp ce escitalopramul cronic a crescut puterea gamma în timpul etapelor de somn cu unde lente (Papp et al., 2018). Cu toate acestea, este încă o întrebare deschisă dacă modificările induse de medicamente ale activității gamma în diferite stadii de vigilență sunt indicatori sau mediatori cauzali ai acțiunii terapeutice, sau semne de efecte secundare (Fitzgerald și Watson, 2018).
Potrivit cunoștințelor noastre, există un decalaj în literatura de specialitate în ceea ce privește efectele antagoniștilor 5-HT2CR selectivi asupra oscilațiilor gamma la om și la rozătoare. Așadar, aici investigăm modul în care se modifică puterea gamma (30-60 Hz) în diferite stadii de vigilență (i) prin administrarea acută a antagonistului 5-HT2CR-antagonist foarte selectiv SB-242084, (ii) prin administrarea cronică a SSRI escitalopram, utilizat pe scară largă, (iii) și prin combinarea acestora.
Metode
În experimente au fost folosiți șobolani Wistar masculi, achiziționați de la Facilitatea locală pentru animale (Universitatea Semmelweis, Budapesta, Ungaria). Animalele au fost ținute în condiții de mediu controlate (21 ± 1°C, ciclu lumină-întuneric de 12/12 h, cu luminile aprinse la ora 10 AM) și li s-a oferit acces liber la hrană standard pentru rozătoare și apă de la robinet. Toate condițiile de adăpostire și experimentele pe animale au fost efectuate în conformitate cu Directiva UE 2010/63/UE și cu „Principiile de îngrijire a animalelor de laborator” ale Institutului Național de Sănătate (National Institutes of Health) (Publicațiile NIH nr. 85-23, revizuite în 1985), precum și cu legile naționale specifice (Regulamentul guvernamental maghiar privind studiile pe animale 40/2013). Experimentele au fost aprobate de către Comitetul științific național de etică pentru experimente pe animale. S-au depus toate eforturile pentru a minimiza durerea și disconfortul animalelor.
Electroencefalografia (EEG) și electrozii electromiografici (EMG) au fost implantați sub anestezie cu 2% halotan, așa cum a fost descris anterior (Jakus et al., 2003). Șobolanii cântăreau 250-280 g la momentul operației. Pentru EEG, electrozii cu șurub din oțel inoxidabil au fost introduși epidural peste cortexul frontal stâng (L: 2,0 mm, A: 2,0 mm până la bregma), cortexul parietal stâng (L: 2,0 mm, A: 2:0 mm până la lambda) și peste cerebel ca electrod de masă. Pentru EMG, o pereche de electrozi EMG (electrozi elastici din oțel inoxidabil acoperiți cu cauciuc siliconic, Plastics One Inc., Roanoke, VA, SUA) a fost plasată în musculatura gâtului. După recuperare (7 zile), șobolanii au fost conectați la sistemul EEG printr-un cablu de înregistrare și un pivot electric fixat deasupra cuștilor. Animalele au rămas conectate pe toată durata studiului.
Pentru pretratamentul cronic, șobolanii au primit 10 mg/kg/zi soluție de escitalopram-oxalat (ESC Gedeon Richter Plc., Ungaria, dizolvată într-o soluție de 0,3 N HCl în apă distilată) sau vehicul (VEH; soluție de 0,3 N HCl în apă distilată) prin intermediul unei minipompe osmotice (2ML4, ALZET, 2,5 μl/h, DURECT Corporation, SUA) timp de 21 de zile. În ziua 21, șobolanii au primit injecții intraperitoneale de 1 mg/kg SB-242084 sau vehicul într-un volum de 1 ml/kg greutate corporală. Șobolanii au fost împărțiți în mod aleatoriu în patru grupuri, după cum urmează: VEH+veh (n = 6), VEH+SB (n = 6), ESC+veh (n = 6) și ESC+SB (n = 6).
EEG, EMG și activitatea motorie au fost înregistrate timp de cel puțin 3 h după injecții, începând de la apariția luminii. Semnalele au fost amplificate prin filtre analogice (Coulburn Lablinc System, SUA; filtrare sub 0,50 Hz și peste 100 Hz la 6 dB/octavă) și supuse conversiei analogic-digitale (MVRD-2200 V, Canopus, Japonia) cu o rată de eșantionare de 128 Hz. Datele au fost stocate pe un computer pentru procesare ulterioară.
Înregistrările poligrafice au fost notate cu ajutorul funcției de notare automată a software-ului Sleep Sign for Animal (Kissei Comtec America Inc., SUA) pentru epoci de 4 s, urmate de supraveghere vizuală. S-au distins șase stadii de vigilență pe baza criteriilor convenționale (Kantor et al., 2004), după cum urmează (a se vedea figura suplimentară 1 pentru urme reprezentative). În starea de veghe activă (AW), EEG-ul este caracterizat de o activitate de amplitudine scăzută la frecvențele beta (14-29 Hz) și alfa (10-13 Hz), pe lângă o activitate EMG și motorie intensă. În starea de veghe pasivă (PW), modelul EEG este similar cu AW, însoțit de o activitate EMG relativ ridicată și de o activitate motorie minimă sau inexistentă. În somnul ușor cu unde lente (SWS-1), EEG-ul se caracterizează prin unde corticale lente de amplitudine mare (0,5-4 Hz) întrerupte de fusuri (6-15 Hz), însoțite de o activitate EMG redusă și de nicio activitate motorie. În somnul profund cu unde lente (SWS-2), EEG-ul este dominat de unde corticale lente continue de mare amplitudine, cu EMG redus și fără activitate motorie. În stadiul intermediar al somnului (IS), care apare mai ales înainte sau după REMS, EEG-ul este caracterizat de o asociere de fusi de mare amplitudine și de unde theta (5-9 Hz). În REMS, EEG-ul este dominat de o activitate de mică amplitudine și de înaltă frecvență cu unde theta regulate, pe lângă EMG-ul silențios și activitatea motorie cu contracții musculare ocazionale (spasme). Au fost eliminate epocile care au fost contaminate cu artefacte sau care conțineau tranziția între etapele de vigilență.
Analiza EEG cantitativă (qEEG) a fost calculată pentru epoci consecutive de 4 s în intervalul de frecvență de 0,5-60 Hz prin intermediul transformării Fourier rapide (fereastră Hanning, rezoluție de frecvență de 0,25 Hz). Bazinele adiacente de 0,25 Hz au fost însumate în bazine de 1 Hz, care sunt marcate de limitele lor superioare. Valorile de putere ale epocilor în AW, PW, SWS-1, SWS-2, IS și REMS au fost mediate separat în rezumatul 3 h, sau în prima, a doua și, respectiv, a treia h, după tratamente pentru a obține valorile densității de putere pentru aceste etape de somn-veghe. În acest raport, ne-am concentrat pe intervalul de frecvență 30-60 Hz al spectrelor de putere EEG. Datele cuprinse între 49-51 Hz au fost excluse din analiză pentru a evita contaminarea zgomotului de interferență de 50 Hz din rețeaua electrică. Toate datele au fost transformate în logaritmi înainte de analiză.
Pentru analiza spectrului de putere, comparațiile între grupuri au fost efectuate prin ANOVA cu două căi pe măsuri repetate cu doi factori principali: tratament (nerepetat) și intervale de frecvență gamma (repetat), urmate de testul post hoc Bonferroni. Pentru a investiga efectele tratamentului în fiecare h, datele de putere rezumate 30-60 Hz (excluzându-le pe cele de 49-51 Hz) au fost analizate utilizând ANOVA cu o singură cale, în ceea ce privește AW, PW, SWS-1, SWS-2, IS și, respectiv, REMS. În urma detectării unui efect principal semnificativ al tratamentului, s-au efectuat teste post-hoc Newman-Keuls. Semnificația statistică a fost acceptată atunci când p < 0,05.
În proiectul nostru experimental, șobolanii de control (VEH+veh) au fost expuși la aceleași proceduri ca și cei tratați cu medicamente. Astfel, compararea grupurilor tratate cu medicamente și a grupului de control are ca scop minimizarea stresului cauzat de injecții și de prezența minipompelor, permițând studierea efectelor medicamentelor. Pentru graficele spectrale, în favoarea unei mai bune vizibilități (deoarece datele de putere EEG urmează o tendință descrescătoare odată cu creșterea frecvențelor), am normalizat valorile de putere ale șobolanilor tratați cu medicamente la valorile spectrale medii de putere ale celor de control (grupul VEH+veh), prezentând astfel date relative. Datele absolute sunt prezentate pe graficele cu bare, ca valori de putere rezumate. Datele sunt exprimate ca medie ± SEM a șase animale pe grup.
Rezultate
Efectele medicamentelor (SB-242084 acut, escitalopram cronic și combinația lor) asupra qEEG în intervalul gamma 30-60 Hz au fost evaluate separat pentru cele șase etape de vigilență prin medierea datelor de putere în primele 3 h ale fazei pasive (Figura 1). Analiza a arătat că toate medicamentele au provocat modificări dependente de stadiul de vigilență în acest interval de frecvență, cu o tendință de creștere în fiecare etapă, în comparație cu grupul VEH + VEh.
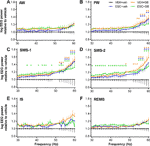
Figura 1 Modificări ale puterii EEG în intervalul de frecvență gamma (30-60 Hz) în urma administrării de SB-242084 acut (VEH+SB), escitalopram cronic (ESC+veh) și a combinației acestora (ESC+SB) în primele 3 h ale fazei pasive. Spectrele de putere sunt prezentate în următoarele șase etape de vigilență: (A) veghe activă (AW) și (B) veghe pasivă (PW), (C) somn ușor (SWS-1) și (D) somn profund cu unde lente (SWS-2), (E) stadiu intermediar (IS) și (F) somn cu mișcare rapidă a ochilor (REMS). Datele privind puterea EEG sunt prezentate ca medie ± SEM, în raport cu grupul de control VEH+veh (n = 6 animale pe grup). *Rezultate semnificative post hoc în comparație cu controlul, p < 0.05.
În timpul AW, rezultatele ANOVA nu au arătat modificări semnificative (efectul tratamentului: F3,20 = 1,917, p = 0,1594; interacțiunea tratament x frecvență: F81,540 = 1,218, p = 0,1081; Figura 1A). Cu toate acestea, în timpul PW, a fost observată o linie de putere moderat crescută în grupurile SB, iar la frecvențele mai mari, de asemenea, în grupul ESC+veh (efectul tratamentului: F3,20 = 2,217, p = 0,1176; interacțiune semnificativă tratament x frecvență: F81,540 = 2,519, p < 0,001; Figura 1B).
Efectele cele mai proeminente au fost observate în timpul etapelor de somn cu unde lente, unde tratamentul acut cu SB-242084, cel cronic cu escitalopram și, de asemenea, tratamentul combinat au provocat o creștere a puterii. Acest lucru a fost susținut de rezultatele semnificative ale ANOVA în SWS-1 (efectul tratamentului: F3,20 = 3,692, p = 0,0290; interacțiune semnificativă tratament x frecvență: F81,540 = 2,693, p < 0,001; Figura 1C), și în SWS-2 (efect semnificativ al tratamentului: F3,20 = 4,787, p = 0,0113; interacțiune semnificativă tratament x frecvență: F81,540 = 1,911, p < 0,001; Figura 1D).
Creșterea puterii gamma nu a fost semnificativă în timpul IS (efectul tratamentului: F3,20 = 2.349, p = 0.1031, interacțiunea tratament x frecvență: F81,540 = 1,241, p = 0,0878; Figura 1E). În cele din urmă, în timpul REMS, nici SB-242084 acut, nici escitalopramul cronic nu au afectat puterea EEG în acest interval de frecvență (efectul tratamentului: F3,19 = 2.515, p = 0.0891; interacțiunea tratament x frecvență: F81,513 = 1,226, p = 0,1014; Figura 1F). Menționăm că au fost utilizate datele doar de la n = 5 animale în grupul ESC+SB, deoarece un animal nu a petrecut niciun timp în REMS în acest interval de timp.
Pentru diferențele semnificative Bonferroni post-hoc în urma rezultatelor semnificative ale ANOVA cu două căi descrise mai sus, consultați Figura 1 pentru fiecare etapă de vigilență. Nu au fost observate diferențe semnificative post hoc în niciunul dintre stadii în ceea ce privește comparațiile dintre VEH+SB vs. ESC+veh, VEH+SB vs. ESC+SB și, respectiv, ESC+veh vs. ESC+SB.
Efectele dependente de stadiul de somn și de veghe ale medicamentelor asupra puterii gamma totale au fost analizate în fiecare oră. One-way ANOVA a arătat că, deși în prima h de SWS-1, efectul tratamentului nu a fost încă semnificativ (F3,20 = 2.544, p = 0.0851), în a doua (F3,20 = 3.331, p = 0.0403) și a treia h (F3,20 = 4.607, p = 0.0131), creșterile de putere au fost semnificative. În SWS-2, ANOVA a arătat efecte semnificative ale tratamentului în fiecare h (F3,18 = 4.062, p = 0.0228; F3,20 = 5.348, p = 0,0072; F3,20 = 4.910, p = 0.0102, respectiv). De asemenea, un efect semnificativ a fost găsit în a doua h de IS (F3,20 = 3,452, p = 0,0360), dar nu și în prima sau a treia h. În cele din urmă, nu a fost găsit niciun efect semnificativ al tratamentului în aceste ore în AW, PW și REMS. Pentru rezultate semnificative post hoc, a se vedea Figura 2 pentru fiecare etapă de vigilență.
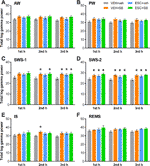
Figura 2 Puterea EEG totală în intervalul de frecvență gamma (30-60 Hz) în urma administrării de SB-242084 acut (VEH+SB), escitalopram cronic (ESC+veh) și combinația acestora (ESC+SB) în prima, a doua și a treia h a fazei pasive, în timpul (A) stării de veghe activă (AW) și (B) stării de veghe pasivă (PW), (C) somnului ușor (SWS-1) și (D) somnului profund cu unde lente (SWS-2), (E) stadiului intermediar (IS) și (F) somnului cu mișcare rapidă a ochilor (REMS). Datele rezumate ale puterii EEG sunt prezentate ca medie ± SEM (de n = 6 animale pe grup). *Rezultate semnificative post hoc în comparație cu grupul de control (VEH+veh), p < 0.05.
Discuție
Este primul studiu care investighează efectele acute ale antagonistului selectiv 5-HT2CR-antagonist SB-242084 asupra benzii de frecvență gamma a spectrelor EEG în diferite stadii de vigilență. În plus, acesta a fost testat cu sau fără pretratarea cronică cu SSRI. Aici raportăm o putere sporită a benzii gamma în timpul SWS-2, SWS-1 și PW după administrarea acută a SB-242084, (1 mg / kg, ip.), la șobolani. Constatările noastre cu privire la pretratamentul suplimentar de 21 zile cu escitalopram (10 mg/kg/zi, minipompe osmotice) demonstrează că SB-242084 nu a modificat în continuare puterea gamma alterată de tratamentul antidepresiv cronic. Mai mult, efectele acute ale SB-242084 și efectele cronice ale escitalopramului asupra puterii gamma au părut foarte asemănătoare în majoritatea stadiilor de vigilență. Cu toate acestea, efectele combinației acestor două tratamente nu au fost considerate ca fiind aditive.
Funcțiile cerebrale legate de activitatea gamma au fost discutate în secțiunea de introducere. Oscilațiile gamma au fost descrise în mai multe zone ale creierului, cum ar fi neocortexul, cortexul entorinal, hipocampul, talamusul, amigdala, bulbul olfactiv și striatum. Generarea lor este legată de inhibiția perisomatică; cel mai mult, de activitatea interneuronilor pozitivi la parvalbumină prin sinapsele de acid gama-aminobutiric (GABA)A (Buzsaki și Wang, 2012). Se crede că oscilațiile gamma joacă un rol important în depresie, lucru susținut atât de constatările umane, cât și de cele animale. Și anume, anomaliile gamma au fost măsurate la pacienții depresivi, dar și la modelele animale de depresie, unde modificările gamma au fost asociate cu recuperarea terapeutică (Khalid et al., 2016; Noda et al., 2017; Fitzgerald și Watson, 2018).
Diverse tratamente farmacologice (care vizează sistemele de serotonină, noradrenalină, dopamină și glutamat) și non-farmacologice ale depresiei au demonstrat că modifică activitatea gamma (Fitzgerald și Watson, 2018). De exemplu, s-a demonstrat că escitalopramul, antidepresivul SSRI utilizat pe scară largă, care acționează asupra sistemului serotoninergic, reduce puterea gamma în timpul REMS prin tratament acut, în timp ce administrarea sa cronică a crescut puterea gamma în etapele de somn cu unde lente, la șobolani (Papp et al., 2018). Este important faptul că antidepresivele care acționează asupra sistemului noradrenergic, cum ar fi reboxetina și desipramină, au crescut puterea gamma (precum și theta) în sistemul septo-hipocampal în urma unui tratament acut, în timp ce SSRI fluvoxamina nu a reușit să producă un astfel de efect în același studiu (Hajos et al., 2003a). S-a demonstrat că antidepresivele presupuse de generație următoare, cum ar fi ketamina și metabolitul său (2R,6R)-hidroxynorketamina, stimulează în mod proeminent puterea gamma atunci când sunt aplicate în doze relevante pentru antidepresie. Aceste efecte și, de asemenea, acțiunile lor asemănătoare antidepresivelor au fost prevenite prin pretratarea cu un inhibitor al receptorului α-amino-3-hidroxi-5-metil-4-isoxazol al acidului propionic (AMPAR) (Zanos et al., 2016). În cele din urmă, Fitzgerald și Watson au propus recent că semnalizarea gamma poate oferi un biomarker al efectelor antidepresive ale tuturor claselor de antidepresive, deoarece, conform ipotezei lor, toate clasele de antidepresive pot avea efecte finale comune asupra circuitelor limbice (Fitzgerald și Watson, 2019).
În acest studiu, am examinat medicamente care acționează asupra sistemului 5-HT, și anume, un antagonist al 5-HT2CR și un SSRI cu acțiunea principală de creștere a nivelului extracelular de 5-HT prin inhibarea recaptării sinaptice a acestuia prin intermediul transportatorului 5-HT. Un număr tot mai mare de dovezi sugerează că antagonismul 5-HT2CR ar putea avea efecte benefice în terapia depresiei și a anxietății, deși aceste efecte ale antagoniștilor selectivi ai 5-HT2CR nu au fost încă testate în studii clinice. În sprijinul relevanței combinării antagoniștilor 5-HT2CR cu ISRS, administrarea concomitentă acută a antagoniștilor selectivi 5-HT2CR SB-242084 sau RS-102221 cu ISRS citalopram a sporit creșterile induse de citalopram ale nivelurilor de 5-HT în regiunile implicate în fiziopatologia tulburărilor depresive, într-un studiu de microdializă la șobolani (Cremers et al., 2004). Pretratamentul cu SB-242084 a inversat, de asemenea, intensificarea acută a expresiei fricii induse de citalopram la șobolani (Burghardt et al., 2007). Mai mult, o lucrare recentă a arătat că tratamentul acut cu SB-242084 după un tratament cronic (21 de zile) cu fluoxetină a redus comportamentele asemănătoare anxietății și depresiei și a ameliorat efectele secundare induse de SSRI la șoareci (Demireva et al., 2018).
În studiul de față, a fost aleasă doza de 1 mg/kg de SB-242084, pe baza studiilor anterioare privind comportamentul (Kennett et al., 1997; Martin et al., 2002; Opal et al., 2014) și somnul și / sau EEG (Popa et al., 2005; Sorman et al., 2011; Bogathy et al., 2019) la rozătoare. Este important faptul că Kantor și colab. au demonstrat că, deși dozele de 0,3 și 1,0 mg/kg de medicament au produs efecte anxiolitice similare, numai doza mai mare a afectat în mod proeminent arhitectura somn-veghe (efect de promovare a trezirii cu reducerea SWS-2), la șobolanii Sprague-Dawley (Kantor și colab., 2005). Un efect de reducere a REMS a fost constatat la doza de 1 mg/kg la șobolanii Wistar, iar creșteri ale puterii theta în timpul AW și REMS au fost, de asemenea, observate în urma acestui tratament (Kostyalik et al., 2014).
Efectul SB-242084 și al escitalopramului asupra activității gamma a fost analizat separat în stadiile de vigilență, deoarece funcțiile cerebrale și activitatea oscilatorie asociată, precum și nivelurile de neurotransmițători prezintă diferențe caracteristice între stadii. Rolul oscilațiilor gamma în funcțiile legate de starea de veghe, cum ar fi atenția concentrată, cogniția și procesarea senzorială, este bine documentat (Cardin, 2016), cu toate acestea, importanța lor funcțională în timpul somnului este mai puțin înțeleasă. În timpul REMS, a fost sugerat un rol al oscilațiilor gamma (dincolo de theta) în consolidarea memoriei (Montgomery et al., 2008). O lucrare recentă a propus că puterea gamma crescută în microstatele REMS fazice în anumite zone este asociată cu procesarea emoțională, la om (Simor et al., 2019). În timpul non-REMS, oscilațiile gamma ar putea fi asociate cu creșteri fazice ale activității neuronale în timpul oscilațiilor lente (Valderrama et al., 2012). Un studiu cu microelectrozi la maimuțe și oameni a subliniat și mai mult rolul oscilațiilor gamma (și beta) în timpul non-REMS, și anume, o coerență ridicată a oscilațiilor sugerează o contribuție o contribuție a gamma la consolidarea memoriei la consolidarea memoriei în timpul non-REMS (Quyen et al, 2016).
Am constatat că o singură doză de SB-242084 a ridicat puterea gamma în timpul SWS-2, SWS-1 și – într-o măsură mai mică – PW, dar nu și în timpul REMS, IS și AW.
Neuronii 5-HT trag cel mai activ în timpul stării de veghe, activitatea lor scade în timpul somnului cu unde lente și tace în timpul REMS. Astfel, sistemul 5-HT a fost considerat un modulator cheie al comportamentului somn-veghe (Monti, 2011) și al oscilațiilor cerebrale, deși mecanismele celulare și receptorii implicați în aceste procese sunt complexe și slab cunoscute (Puig și Gener, 2015). S-a constatat că 5-HT în sine afectează activitatea gamma în cortexul prefrontal de șobolan prin intermediul 5-HT1ARs și 5-HT2ARs, dar nu și 5-HT2CRs, ceea ce duce la o scădere generală a amplitudinii la șobolanii anesteziați (Puig et al., 2010). Mai mult, există tot mai multe dovezi care susțin importanța sistemului DA în sincronizarea interneuronilor cu spike rapid, generând/reglementând astfel oscilațiile gamma (Furth et al., 2013).
5-HT2CR este probabil subtipul de receptor 5-HT cu cea mai răspândită distribuție în creier. Acesta a fost descris pe interneuronii GABAergici în numeroase regiuni și este exprimat și de neuronii DA. Cu toate acestea, acest subtip de receptor nu este exprimat de neuronii 5-HT și noradrenergici (NA). Rolul 5-HT2CRs în modularea sistemelor monoaminergice și, în mod intrigant, a sistemelor DA a fost subliniat de mai multe studii preclinice (Di Giovanni și De De Deurwaerdere, 2016; De De Deurwaerdere și Di Giovanni, 2017). Stimularea locală a 5-HT2CR în zone specifice ale creierului a produs anxietate într-o manieră dependentă de regiune și, la rândul său, antagoniștii 5-HT2CR subtip selectivi, cum ar fi SB-242084, au exercitat acțiuni anxiolitice marcate (Bagdy și colab., 2001; Di Giovanni și De De Deurwaerdere, 2016). Mai multe anxiolitice și antidepresive posedă proprietăți antagoniste 5-HT2CR, de exemplu, numeroase antidepresive triciclice, mianserina, mirtazapina, trazodona, nefazodona, fluoxetina și agomelatina (Martin et al., 2014). Pe de altă parte, antagoniștii selectivi 5-HT2CR au fost sugerați ca antidepresive cu debut rapid putative pe baza studiilor preclinice (Opal et al., 2014).
S-au publicat câteva studii privind efectele calitative (care afectează arhitectura somn-veghe) și cantitative (care afectează spectrele de putere, adică oscilațiile) ale antagoniștilor 5-HT2CR, și în special ale SB-242084, asupra somnului-veghe. Kantor și colab. au investigat efectele dependente de doză ale SB-242084 asupra anxietății, vigilenței și spectrelor EEG sub 30 Hz la șobolani. Aceștia au constatat o creștere a puterii theta în stare de veghe (care sugerează un posibil efect de ameliorare cognitivă, deoarece activitatea theta este asociată cu procesele de învățare și memorie) chiar și la o doză de 0,1 mg/kg. În schimb, medicamentul a crescut trezirea și a suprimat SWS-2 în prima h a fazei pasive doar la doza de 1 mg/kg. În ceea ce privește benzile de frecvență delta, alfa sau beta în timpul stării de veghe, REMS, SWS-1 sau SWS-2, nu a fost raportată nicio alterare semnificativă în această lucrare (Kantor et al., 2005). Kostyalik și colab. au descris faptul că SB-242084 a ridicat durata PW și a suprimat REMS, efect care a fost atenuat prin pretratarea cronică cu CES, la șobolani. În ceea ce privește qEEG, aceștia au constatat o putere theta crescută în timpul AW și, de asemenea, în timpul REMS, care nu a fost modificată în continuare prin pretratarea cronică cu escitalopram (Kostyalik et al., 2014). Efectul de intensificare a activității theta al antagonistului 5-HT2CR și, prin urmare, rolul 5-HT2CR în reglarea activității theta au fost susținute de Hajos et al. (2003b).
Efectele escitalopramului și ale altor SSRI asupra arhitecturii somn-veghe și a parametrilor EEG la oameni și rozătoare sunt studiate mai pe larg (Wilson și Argyropoulos, 2005; Vas et al., 2013; Fitzgerald și Watson, 2019). Recent, am raportat modificări ale puterii gamma în urma administrării acute (reducere în timpul REMS) și cronice (creștere în timpul SWS-1 și SWS-2) la șobolani (Papp și colab., 2018).
În mod interesant, efectele acute ale SB-242084 au fost similare cu cele cauzate de escitalopramul cronic, cu alte cuvinte, antagonismul selectiv asupra 5-HT2CR a produs efecte similare asupra activității gamma ca blocarea cronică a transportorului 5-HT și efectele suplimentare pe care le exercită escitalopramul. În acest caz, presupunem că efectele 5-HT, și anume, desensibilizarea 5-HT1AR (și posibil și 5-HT2AR) pot explica creșterea puterii gamma în acele etape, așa cum am propus în lucrarea noastră anterioară (Papp și colab., 2018).
Pentru a explica constatările noastre, trebuie să luăm în considerare faptul că 5-HT2CR poate modula activitatea neuronală 5-HT, NA și, în mod important, DA (Di Giovanni și De Deurwaerderedere, 2016). Activitatea constitutivă a 5-HT2CRs a fost raportată pentru a exercita un control inhibitor asupra activității neuronilor DA, care a fost inversată prin administrarea sistemică a antagoniștilor 5-HT2CR. SB-242084 și SB-206553 au sporit semnificativ eliberarea DA bazală în zonele inervate de DA din creierul de șobolan. Cu toate acestea, eliberarea DA provocată de SB-242084 a fost mică și a atins un maxim în comparație cu SB-206553 (De De Deurwaerdere și colab., 2004). În mod interesant, SSRI-urile au fost, de asemenea, implicate în reglarea semnalizării DAergice (care ar putea indica o posibilă caracteristică comună a celor două medicamente investigate), deși datele disponibile în literatura de specialitate sunt ambigue. În timp ce s-a raportat că escitalopramul acut crește rata de declanșare și explozia neuronilor din zona tegmentală ventrală (Schilstrom et al., 2011), un alt studiu a demonstrat că o administrare de escitalopram timp de 2 săptămâni a scăzut rata de declanșare și explozia acestor neuroni, la șobolani anesteziați (Dremencov et al., 2009).
Constatările acestui studiu trebuie interpretate în contextul unor limitări. SB-242084 a fost administrat într-o singură doză și nu am testat dacă efectul de amplificare gamma al medicamentului este dependent de doză. În plus, analiza noastră a fost limitată la un maxim de 60 Hz din cauza limitei Nyquist determinată de rata nominală de eșantionare, astfel încât sunt necesare lucrări suplimentare pentru a investiga frecvențele gamma mai rapide, precum și oscilațiile de înaltă frecvență (HFO) și ondulațiile.
Consumate, constatările noastre arată efecte similare între SB-242084 acut și escitalopramul cronic asupra activității gamma, care susțin dovezile preclinice (și clinice indirecte) că tratamentul acut sau pe termen scurt cu 5-HT2CR-antagoniști poate avea efecte antidepresive. Astfel, lucrarea noastră ar putea oferi dovezi suplimentare că antagoniștii 5-HT2CR-antagoniști pot fi benefici în tratamentul depresiei și/sau al anxietății. Dacă modificările activității gamma sunt markeri ai acțiunii terapeutice a medicamentelor sau mediatori ai efectului terapeutic, rămâne o întrebare nerezolvată care necesită studii suplimentare.
Declarație privind disponibilitatea datelor
Seturile de date generate și analizate în timpul studiului actual nu sunt disponibile publicului din cauza analizei în curs de desfășurare pentru o viitoare publicare, dar sunt disponibile de la autorul corespondent la o cerere rezonabilă.
Declarație etică
Toate condițiile de adăpostire și experimentele pe animale au fost efectuate în conformitate cu Directiva UE 2010/63/UE și cu „Principiile de îngrijire a animalelor de laborator” ale Institutelor Naționale de Sănătate (NIH Publications nr. 85-23, revizuite în 1985), precum și cu legile naționale specifice (Regulamentul guvernamental maghiar privind studiile pe animale 40/2013). Experimentele au fost aprobate de către Comitetul științific național de etică pentru experimente pe animale și au fost permise de către guvern (Direcția pentru siguranța lanțului alimentar și sănătatea animală a Oficiului Central Agricol, Autorizația nr. 22.1/1375/7/2010).
Contribuții ale autorilor
GB și TK au conceput experimentele. DK, SV și PP au efectuat procedurile experimentale. GB, DK, DK, SV și NP au contribuit la analiza datelor. NP, SK, SV și GB au interpretat rezultatele. NP, SK și GB au redactat prima versiune a manuscrisului. Toți autorii au citit și aprobat manuscrisul final.
Finanțare
Această lucrare a fost susținută de Agenția Națională de Dezvoltare (KTIA_NAP_13-1-2013-0001) Programul maghiar de cercetare a creierului (Grant nr. KTIA_13_NAP-A-II/14), NAP 2.0 (Grant nr. 2017-1.2.1-NKP-2017-00002); Programul tematic de excelență ITM/NKFIH, Universitatea Semmelweis; și grantul SE-Neurologie FIKP al EMMI.
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Le mulțumim lui Zita Kátai și Emese Bogáthy pentru asistența lor în experimentele și/sau analiza datelor.
Materiale suplimentare
Materialul suplimentar pentru acest articol poate fi găsit online la:
Supplementary Material
The Supplementary Material for this article can be found online at: https://www.frontiersin.org/articles/10.3389/fphar.2019.01636/full#supplementary-material
Bagdy, G., Graf, M., Anheuer, Z. E., Modos, E. A., Kantor, S. (2001). Efectele asemănătoare anxietății induse de tratamentul acut cu fluoxetină, sertralină sau m-CPP sunt inversate de pretratamentul cu antagonistul receptorului 5-HT2C SB-242084, dar nu și cu antagonistul receptorului 5-HT1A WAY-100635. Int. J. Neuropsychopharmacol. 4 (4), 399-408. doi: 10.1017/S1461145701002632
PubMed Abstract | Textul integral | Google Scholar
Bagdy, G. (1998). Serotonina, anxietatea și hormonii de stres. Accent pe subtipurile receptorilor 5-HT, pe diferențele dintre specii și gen. Ann. N. Y. Acad. Sci. 851, 357-363. doi: 10.1111/j.1749-6632.1998.tb09009.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogathy, E., Papp, N., Tothfalusi, L., Vas, S., Bagdy, G. (2019). Efectul aditiv al blocării receptorilor 5-HT2C și CB1 asupra reglării ciclului somn-veghe. BMC Neurosci. 20 (1), 14. doi: 10.1186/s12868-019-0495-7
PubMed Abstract | Full CrossRef Text | Google Scholar
Burghardt, N. S., Bush, D. E., McEwen, B. S., LeDoux, J. E. (2007). Inhibitorii selectivi de recaptare a serotoninei acute selective cresc expresia fricii condiționate: blocarea cu un antagonist al receptorului 5-HT (2C). Biol. Psychiatry 62 (10), 1111-1118. doi: 10.1016/j.biopsych.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., Wang, X. J. (2012). Mecanismele oscilațiilor gamma. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
PubMed Abstract | Textul integral | Google Scholar
Cardin, J. A. (2016). Instantanee ale creierului în acțiune: operațiuni de circuit local prin prisma oscilațiilor gamma. J. Neurosci. 36 (41), 10496-10504. doi: 10.1523/JNEUROSCI.1021-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Chagraoui, A., Thibaut, F., Skiba, M., Thuillez, C., Bourin, M. (2016). Receptorii 5-HT2C în tulburările psihiatrice: o revizuire. Prog. Neuropsychopharmacol. Biol. Psychiatry 66, 120-135. doi: 10.1016/j.pnpbp.2015.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Cremers, T. I., Giorgetti, M., Bosker, F. J., Hogg, S., Arnt, J., Mork, A., et al. (2004). Inactivarea receptorilor 5-HT(2C) potențează consecințele blocării recaptării serotoninei. Neuropsychopharmacology 29 (10), 1782-1789. doi: 10.1038/sj.npp.1300474
PubMed Abstract | CrossRef Full Text | Google Scholar
De De Deurwaerdere, P., Di Giovanni, G. (2017). Modularea serotoninergică a activității sistemelor dopaminergice mezencefalice: implicații terapeutice. Prog. Neurobiol. 151, 175-236. doi: 10.1016/j.pneurobio.2016.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
De De Deurwaerdere, P., Navailles, S., Berg, K. A., Clarke, W. P., Spampinato, U. (2004). Activitatea constitutivă a receptorului serotonin2C inhibă eliberarea de dopamină in vivo în striatum și nucleul accumbens de șobolan. J. Neurosci. 24 (13), 3235-3241. doi: 10.1523/JNEUROSCI.0112-04.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Dekeyne, A., Denorme, B., Monneyron, S., Millan, M. J. (2000). Citalopramul reduce interacțiunea socială la șobolani prin activarea receptorilor de serotonină (5-HT)(2C). Neuropharmacology 39 (6), 1114-1117. doi: 10.1016/s0028-3908(99)00268-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Demireva, E. Y., Suri, D., Morelli, E., Mahadevia, D., Chuhma, N., Teixeira, C. M., et al. (2018). Blocarea receptorilor 5-HT2C inversează disfuncția ganglionilor bazali asociată cu SSRI și potențează eficacitatea terapeutică. Mol. Psychiatry. doi: 10.1038/s41380-018-0227-x
CrossRef Full Text | Google Scholar
Di Giovanni, G., De Deurwaerdere, P. (2016). Noi oportunități terapeutice pentru liganzii receptorilor 5-HT2C în tulburările neuropsihiatrice. Pharmacol. Ther. 157, 125-162. doi: 10.1016/j.pharmthera.2015.11.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Dremencov, E., El Mansari, M., Blier, P. (2009). Efectele inhibării susținute a recaptării serotoninei asupra declanșării neuronilor dopaminei în zona tegmentală ventrală a șobolanului. J. Psychiatry Neurosci. 34 (3), 223-229.
PubMed Abstract | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2018). Oscilațiile gamma ca biomarker pentru depresia majoră: un subiect emergent. Transl. Psihiatrie 8 (1), 177. doi: 10.1038/s41398-018-0239-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2019). Înregistrări electrofiziologice in vivo ale efectelor medicamentelor antidepresive. Exp. Brain Res. 237 (7), 1593-1614. doi: 10.1007/s00221-019-05556-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Furth, K. E., Mastwal, S., Wang, K. H., Buonanno, A., Vullhorst, D. (2013). Dopamina, funcția cognitivă și oscilațiile gamma: rolul receptorilor D4. Front. Cell Neurosci. 7, 102. doi: 10.3389/fncel.2013.00102
PubMed Abstract | Text integral | Google Scholar
Hajos, M., Hoffmann, W. E., Robinson, D. D., Yu, J. H., Hajos-Korcsok, E. (2003a). Inhibitorii recaptării norepinefrinei, dar nu și ai recaptării serotoninei, sporesc activitatea theta și gamma a sistemului septo-hipocampal. Neuropsihofarmacologie 28 (5), 857-864. doi: 10.1038/sj.npp.1300116
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Weaver, R. J. (2003b). Reglarea activității septo-hipocampale de către receptorii 5-hidroxitriptaminei (2C). J. Pharmacol. Exp. Ther. 306 (2), 605-615. doi: 10.1124/jpet.103.051169
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakus, R., Graf, M., Juhasz, G., Gerber, K., Levay, G., Halasz, P., et al. (2003). Receptorii 5-HT2C inhibă și receptorii 5-HT1A activează generarea descărcărilor de vârfuri-undă într-un model genetic de șobolan de epilepsie de absență. Exp. neurol. 184 (2), 964-972. doi: 10.1016/S0014-4886(03)00352-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Balogh, B., Benko, A., Bagdy, G. (2004). Creșterea stării de veghe, a activității motorii și scăderea activității theta după blocarea receptorului 5-HT2B de către antagonistul subtipului selectiv SB-215505. Br. J. Pharmacol. 142 (8), 1332-1342. doi: 10.1038/sj.bjp.0705887
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Molnar, E., Gyongyosi, N., Toth, A., Detari, L., et al. (2005). În ciuda unui potențial anxiolitic similar, antagonistul receptorului 5-hidroxitriptaminei 2C SB-242084 indoline] și clordiazepoxidul au produs efecte diferențiale asupra spectrelor de putere ale electroencefalogramelor. J. Pharmacol. Exp. Ther. 315 (2), 921-930. doi: 10.1124/jpet.105.086413
PubMed Abstract | CrossRef Full Text | Google Scholar
Kennett, G. A., Wood, M. D., Bright, F., Trail, B., Riley, G., Holland, V., et al. (1997). SB 242084, un antagonist selectiv și penetrant în creier al receptorilor 5-HT2C. Neuropharmacology 36 (4-5), 609-620. doi: 10.1016/s0028-3908(97)00038-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Khalid, A., Kim, B. S., Seo, B. A., Lee, S. T., Jung, K. H., Chu, K., et al. (2016). Oscilația gamma în rețelele funcționale ale creierului este implicată în remisiunea spontană a comportamentului depresiv indus de stresul de constrângere cronică la șoareci. BMC Neurosci. 17, 4. doi: 10.1186/s12868-016-0239-x
PubMed Abstract | Text integral | Google Scholar
Kostyalik, D., Katai, Z., Vas, S., Pap, D., Petschner, P., Molnar, E., et al. (2014). Tratamentul cronic cu escitalopram a provocat o adaptare disociativă în efectele induse de antagonistul receptorului serotoninei (5-HT) 2C în somnul REM, trezirea și activitatea undelor theta. Exp. Brain Res. 232 (3), 935-946. doi: 10.1007/s00221-013-3806-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, J. R., Ballard, T. M., Higgins, G. A. (2002). Influența antagonistului receptorului 5-HT2C, SB-242084, în testele de anxietate. Pharmacol. Biochem. Behav. 71 (4), 615-625. doi: 10.1016/s0091-3057(01)00713-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, C. B., Hamon, M., Lanfumey, L., Mongeau, R. (2014). Controverse privind rolul receptorilor 5-HT(2C) în mecanismele de acțiune ale medicamentelor antidepresive. Neurosci. Biobehav. Rev. 42, 208-223. doi: 10.1016/j.neubiorev.2014.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Montgomery, S. M., Sirota, A., Buzsaki, G. (2008). Coordonarea Theta și gamma a rețelelor hipocampale în timpul stării de veghe și a somnului cu mișcare rapidă a ochilor. J. Neurosci. 28 (26), 6731-6741. doi: 10.1523/JNEUROSCI.1227-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Monti, J. M. (2011). Controlul serotoninei asupra comportamentului de somn-veghe. Sleep Med. Rev. 15 (4), 269-281. doi: 10.1016/j.smrv.2010.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Noda, Y., Zomorrodi, R., Saeki, T., Rajji, T. K., Blumberger, D. M., Daskalakis, Z. J., et al. (2017). Puterea gamma EEG în stare de repaus și creșterea cuplării theta-gamma după rTMS prefrontal dorsolateral stânga de înaltă frecvență la pacienții cu depresie. Clin. Neurophysiol. 128 (3), 424-432. doi: 10.1016/j.clinph.2016.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Opal, M. D., Klenotich, S. C., Morais, M., Bessa, J., Winkle, J., Doukas, D., et al. (2014). Antagoniștii receptorilor de serotonină 2C induc efecte antidepresive cu debut rapid. Mol. Psychiatry 19 (10), 1106-1114. doi: 10.1038/mp.2013.144
PubMed Abstract | Refef Full Text | Google Scholar
Papp, N., Vas, S., Bogathy, E., Katai, Z., Kostyalik, D., Bagdy, G. (2018). Escitalopramul acut și cronic modifică diferit oscilațiile gamma EEG: relevanță pentru efectele terapeutice. Eur. J. Pharm. Sci. 121, 347-355. doi: 10.1016/j.ejps.2018.06.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Popa, D., Lena, C., Fabre, V., Prenat, C., Gingrich, J., Escourrou, P., et al. (2005). Contribuția subtipurilor de receptori 5-HT2 la somn-veghea și la controlul respirator, precum și adaptări funcționale la șoarecii knock-out lipsiți de receptorii 5-HT2A. J. Neurosci. 25 (49), 11231-11238. doi: 10.1523/JNEUROSCI.1724-05.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Gener, T. (2015). Modularea serotoninei a ritmurilor prefronto-hipocampale în sănătate și boală. ACS Chem. Neurosci. 6 (7), 1017-1025. doi: 10.1021/cn500350e
PubMed Abstract | Refef Full Text | Google Scholar
Puig, M. V., Watakabe, A., Ushimaru, M., Yamamori, T., Kawaguchi, Y. (2010). Serotonina modulează interneuronii cu spike rapid și activitatea sincronă în cortexul prefrontal de șobolan prin intermediul receptorilor 5-HT1A și 5-HT2A. J. Neurosci. 30 (6), 2211-2222. doi: 10.1523/JNEUROSCI.3335-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Quyen, M. L. V., Muller, L. E., Telenczuk, B., Halgren, E., Cash, S., Hatsopoulos, N. G., et al. (2016). Oscilații de înaltă frecvență în neocortexul uman și de maimuță în timpul ciclului de veghe-somn. Proc. Natl. acad. Sci. U. S. A. 113 (33), 9363-9368. doi: 10.1073/pnas.1523583113
PubMed Abstract | CrossRef Full Text | Google Scholar
Schilstrom, B., Konradsson-Geuken, A., Ivanov, V., Gertow, J., Feltmann, K., Marcus, M. M., et al. (2011). Efectele S-citalopramului, citalopramului și R-citalopramului asupra modelelor de ardere a neuronilor dopaminei în zona tegmentală ventrală, transmisia mediată de receptorul N-metil-D-aspartat în cortexul prefrontal medial și funcția cognitivă la șobolan. Synapse 65 (5), 357-367. doi: 10.1002/syn.20853
PubMed Abstract | Refef Full Text | Google Scholar
Simor, P., van Der Wijk, G., Gombos, F., Kovacs, I. (2019). Paradoxul somnului de mișcare rapidă a ochilor în lumina activității oscilatorii și a sincronizării corticale în timpul microstatelor fazice și tonice. Neuroimage 202, 116066. doi: 10.1016/j.neuroimage.2019.116066
PubMed Abstract | CrossRef Full Text | Google Scholar
Sorman, E., Wang, D., Hajos, M., Kocsis, B. (2011). Controlul ritmului theta hipocampal al hipocampului de către serotonină: rolul receptorilor 5-HT2c. Neuropharmacology 61 (3), 489-494. doi: 10.1016/j.neuropharm.2011.01.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiger, A., Kimura, M. (2010). EEG de veghe și de somn oferă biomarkeri în depresie. J. Psychiatr. Res. 44 (4), 242-252. doi: 10.1016/j.jpsychires.2009.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Valderrama, M., Crepon, B., Botella-Soler, V., Martinerie, J., Hasboun, D., Alvarado-Rojas, C., et al. (2012). Oscilațiile gamma umane în timpul somnului cu unde lente. PloS One 7 (4), e33477. doi: 10.1371/journal.pone.0033477
PubMed Abstract | CrossRef Full Text | Google Scholar
Vas, S., Katai, Z., Kostyalik, D., Pap, D., Molnar, E., Petschner, P., et al. (2013). Adaptarea diferențială a latenței somnului REM, a stadiului intermediar și a efectelor puterii theta ale escitalopramului după tratamentul cronic. J. Neural Transm. (Viena) 120 (1), 169-176. doi: 10.1007/s00702-012-0847-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilson, S., Argyropoulos, S. (2005). Antidepresivele și somnul: o analiză calitativă a literaturii. Drugs 65 (7), 927-947. doi: 10.2165/00003495-200565070-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanos, P., Moaddel, R., Morris, P. J., Georgiou, P., Fischell, J., Elmer, G. I., et al. (2016). Acțiuni antidepresive independente de inhibiția NMDAR a metaboliților ketaminei. Nature 533 (7604), 481-486. doi: 10.1038/nature17998
PubMed Abstract | CrossRef Full Text | Google Scholar
.