principalul constituent funcțional al globulelor roșii, servind ca proteină care transportă oxigenul; este un tip de hemoproteină în care fiecare moleculă este un tetramer compus din patru monomeri ținuți împreună prin legături slabe. Este formată din două perechi de lanțuri polipeptidice, globinele, fiecare având atașată câte o moleculă de heme compusă din fier plus o moleculă de protoporfirină. Simbol Hb.
Atomul de fier are valență liberă și poate lega o moleculă de oxigen. Astfel, fiecare moleculă de hemoglobină poate lega o moleculă de oxigen. Legarea oxigenului de către un monomer crește afinitatea pentru oxigen a celorlalți din tetramer. Acest lucru face ca hemoglobina să fie o proteină de transport mai eficientă decât o proteină monomerică precum mioglobina.
Hemoglobina oxigenată (oxihemoglobina) este de culoare roșu aprins; hemoglobina nelegată de oxigen (deoxihemoglobina) este mai închisă la culoare. Acest lucru explică culoarea roșu aprins a sângelui arterial, în care hemoglobina este saturată cu oxigen în proporție de aproximativ 97%. Sângele venos este mai închis la culoare deoarece este saturat doar în proporție de aproximativ 20 până la 70 la sută, în funcție de cantitatea de oxigen utilizată de țesuturi. Afinitatea hemoglobinei pentru monoxidul de carbon este de 210 ori mai puternică decât afinitatea sa pentru oxigen. Complexul format (carboxihemoglobina) nu poate transporta oxigenul. Astfel, intoxicația cu monoxid de carbon duce la hipoxie și asfixiere.
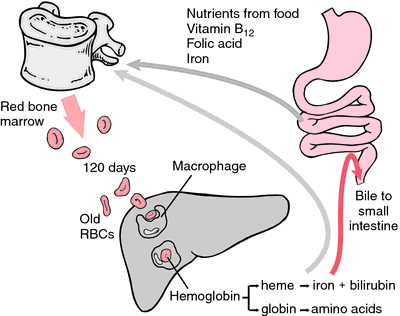
O altă formă de hemoglobină care nu poate transporta oxigenul este metemoglobina, în care atomul de fier este oxidat până la starea de oxidare +3. În timpul celor 120 de zile de viață ale unui globule roșii, hemoglobina se oxidează lent în methemoglobină. Cel puțin patru sisteme enzimatice diferite pot transforma methemoglobina înapoi în hemoglobină. Atunci când acestea sunt defecte sau supraîncărcate, poate rezulta methemoglobinemia, nivelurile ridicate de methemoglobină provocând dispnee și cianoză.
O funcție secundară a hemoglobinei este aceea de parte a sistemului tampon al sângelui. Reziduurile de histidină din lanțurile globinice acționează ca baze slabe pentru a minimiza modificarea pH-ului sângelui care are loc pe măsură ce oxigenul este absorbit și dioxidul de carbon eliberat în plămâni și pe măsură ce oxigenul este livrat și dioxidul de carbon preluat din țesuturi.
Pe măsură ce eritrocitele se uzează sau sunt deteriorate, ele sunt ingerate de macrofagele sistemului reticuloendotelial. Inelul porfirinic al hemului este transformat în pigmentul biliar bilirubină, care este excretat de ficat. Fierul este transportat către măduva osoasă pentru a fi încorporat în hemoglobina eritrocitelor nou formate.
Concentrația hemoglobinei din sânge variază în funcție de hematocrit. Valorile normale pentru concentrația de hemoglobină din sânge sunt cuprinse între 13,5 și 18,0 g/100 ml la bărbați și între 12,0 și 16,0 g/100 ml la femei. Concentrația medie normală a hemoglobinei corpusculare, care este concentrația din interiorul globulelor roșii, este de 32 până la 36 g/100 ml.
Au fost descoperite multe hemoglobine anormale rezultate din mutații. Unele au afinitatea pentru oxigen modificată, altele sunt instabile, iar la unele atomul de fier este oxidat, rezultând methemoglobinemia congenitală. Unele mutații au ca rezultat o rată redusă de sinteză a hemoglobinei. Toate aceste afecțiuni sunt cunoscute sub numele de hemoglobinopatii.
Cea mai frecventă hemoglobinopatie este boala celulelor secerătoare, cauzată de o mutație care înlocuiește cel de-al șaselea aminoacid din lanțul β, în mod normal acid glutamic, cu valină. Varianta de hemoglobină α2βS2 este cunoscută sub numele de Hb S. Mutațiile care determină o sinteză redusă a unuia dintre lanțuri se numesc talasemii. Ele pot rezulta din deleția genei pentru un lanț sau dintr-o mutație în gena regulatoare care controlează sinteza lanțului.
.