Introducere
Artrita reumatoidă (AR) este o boală autoimună, de natură poligenică, caracterizată prin poliartrită cu manifestări sistemice și morbiditate crescută și severă.1,2 AR afectează 0,5%-1% din populație, determinând o scădere a calității vieții, un handicap fizic semnificativ și un cost economic substanțial.3-6 Expresia clinică a bolii este variată, variind de la forme ușoare autolimitate până la o evoluție foarte agresivă, rapidă, care culminează cu distrugerea articulației afectate și handicapul rezultat.7
Studiile genetice au confirmat existența unui substrat genetic, parțial legat de anumite gene care codifică proteine implicate în răspunsul celulelor T.1 Aceste descoperiri întăresc importanța rolului atribuit celulelor T în inițierea și perpetuarea răspunsului imunitar anormal în această boală.8
Patogeneza PR este complexă și implică diferite populații celulare legate de răspunsul imunitar înnăscut și adaptativ. Celulele rezidente din sinovială, cum ar fi sinoviocitele fibroblastice B sau macrofagele din intime, și celulele inflamatorii din sânge ca limfocitele T, limfocitele B și monocitele9 sunt implicate în patogeneză. Toate acestea contribuie la transformarea agresivă a fenotipului sinoviocitelor B și la dezvoltarea unui infiltrat inflamator intens cu rezultatul final de distrugere a cartilajului și a osului subcondral10,11 (Fig. 1).
Pathofiziologia artritei reumatoide. Organizarea fiziopatologică generală a poliartritei reumatoide. AC, anticorp; BAFF, factor de activare a celulelor B; BLyS, stimulator al limfocitelor B; CD, cluster de diferențiere; CPA, celulă prezentatoare de antigen; CPH, MHC; CTLA4, antigen asociat limfocitelor 4 T citotoxic C5a fracțiune complement 5a, FR, factor reumatoid; Ig, imunoglobulină; IL, interleukină; MMP, metaloproteinaze matriciale; RANK, receptor activator al factorului nuclear B kappa; RANKL, ligand activator al receptorului pentru factorul nuclear B kappa; RCT, receptor de celule T; TNF, factor de necroză tumorală.
Tratamentul actual al PR se bazează pe administrarea de medicamente antireumatice modificatoare de boală (DMARD) utilizate singure sau în combinație.12 Aceste medicamente încetinesc distrugerea articulară, adică sunt capabile să modifice evoluția naturală a bolii.4,13 Cu toate acestea, procentul de pacienți cu un răspuns clinic satisfăcător este scăzut și necesită adesea adăugarea unui medicament biologic la un procent ridicat de pacienți.9,13-15
În ultimii ani au fost identificate noi molecule și ținte terapeutice a căror blocare ar putea reduce sau elimina răspunsul inflamator cronic. Una dintre aceste noi molecule este abataceptul. Abatacept este o construcție proteică complet umanizată, formată din domeniul extracelular al antigenului 4 asociat limfocitelor T citotoxice umane (CTL4) și un fragment modificat genetic al regiunii Fc a imunoglobulinei G1 umane (IgG1), care inhibă celulele T de costimulare care acționează pe nucleul adevărat al răspunsului imunitar și, prin urmare, la debutul bolii.
Activarea celulelor T
Activarea imună eficientă a celulelor T necesită participarea a două grupuri de receptori membranari pe celulele prezentatoare de antigen (APC)14 (fig. 1 și 2). Primul este vehiculul utilizat de APC pentru a furniza celulei T antigenul specific prelucrat anterior. În ciuda efortului enorm dedicat acestei cercetări, încă nu am reușit să identificăm antigenele artritogene care declanșează AR.8 Prezentarea de către APC a unui antigen împotriva căruia se instalează un răspuns imunitar specific este organizată printr-un complex trimolecular care cuprinde: moleculele complexului major de histocompatibilitate (MHC) prezente în APC, antigenul împotriva căruia se dezvoltă răspunsul imunitar și un receptor membranar pe celula T (TCR) specific pentru acel antigen15 (calea de semnal sau de semnalizare a răspunsului imunitar 1).
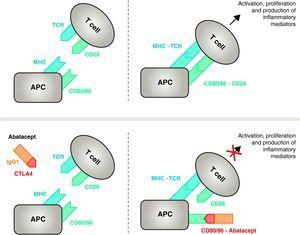
Mecanismul de acțiune al abataceptului. Fragmentul de abatacept care cuprinde domeniul extracelular al CTLA4 se leagă de receptorii CD80/CD86, împiedicând sau deplasând interacțiunea acestuia cu receptorul CD28. În acest mod, blochează selectiv legarea specifică a CD80/CD86 la receptorul CD28, ceea ce reprezintă, fiziopatologic, un blocaj al celui de-al doilea semnal de activare imunitară și, prin urmare, activarea celulelor T CPA, celulă prezentatoare de antigen; MHC, complex major de histocompatibilitate; TCR, receptor de celule T.
Pentru a inhiba activarea completă, celulele T au nevoie de un al doilea set de receptori de comunicare intercelulară între APC și celulele T, care are loc prin intermediul căilor costimulatoare și constituie așa-numitul răspuns imunitar cu 2 semnale.14 Deși există mai multe căi de costimulare, una este esențială, legarea receptorilor CD80 (B7-1)/CD86 (B7-2) de pe membrana APC cu receptorul CD28 de pe celulele T.10,16 Activarea simultană a ambelor declanșează o semnalizare intracelulară intensă în celulele T, esențială pentru activarea completă, proliferarea, supraviețuirea și producerea de citokine 8. La 24-48h de la activarea limfocitelor T, aceeași semnalizare intracelulară inițiază un mecanism de reglementare care are ca scop dezactivarea răspunsului propriu-zis. Aceasta induce exprimarea CTLA411 pe membrana celulară a limfocitelor cu sarcina de a concura cu CD28 datorită afinității sale mai mari de legare la CD80/CD86.17,18
Activarea ambelor subseturi de celule T, CD4+ și CD8+ depinde de receptorul costimulator CD28. Celulele T CD4+ sunt celule T ajutătoare. Acestea recunosc peptidele prezentate de moleculele MHC clasa II prezente pe APC. Aceste antigene provin din calea exogenă care procesează agenții patogeni, cum ar fi bacteriile. Multe boli autoimune sunt asociate cu un răspuns patologic al celulelor T CD4+. La rândul lor, celulele T CD8+ sunt limfocite citotoxice (CTL). Celulele T CD8+ recunosc antigene, în principal virale și tumorale prezentate de moleculele de clasă I MHC. În urma activării, celulele CD8+ mediază distrugerea celulelor țintă prin producerea de perforină, granzime și interferon (IFN)-g. Ambele subtipuri de celule T sunt activate prin costimulare cu CD2815, deși activarea celulelor T CD8+ este mai puțin dependentă de această cale de costimulare. De fapt, în timp ce toate celulele CD4+ exprimă CD28 pe membrana lor, acest lucru se întâmplă doar la aproximativ 50% din CD8+.19 În plus, s-a demonstrat că celulele CD4+ prezintă un răspuns mai mare la legarea CD2820. Mai mult, promotorul CD28 nu este o cerință absolută pentru activarea CTL.21 Toate acestea ar oferi un dublu beneficiu terapeutic în practica clinică. Pe de o parte, abataceptul acționează preferențial asupra celulei țintă în patogeneza bolii. Pe de altă parte, acțiunea redusă asupra activității limfocitelor CD8+ ar asigura un profil de siguranță mai bun în ceea ce privește complicațiile virale și tumorale.
Activarea limfocitelor T CD4+ este punctul de plecare pentru o cascadă proinflamatorie cu producere de cantități mari de citokine și proliferare celulară care, dacă este perpetuată și întreținută, ca în AR, duce la o inflamație cronică foarte activă, capabilă să distrugă țesuturile în care se declanșează, în principal articulațiile în cazul AR8 (Fig. 1). Sinovia începe să prolifereze datorită celulelor infiltrate din sânge, inclusiv a limfocitelor T propriu-zise și a subtipurilor lor, precum și a limfocitelor B Monocitele se diferențiază în macrofage și osteoclaste și, de asemenea, activează condrocitele articulare. În acest mediu există cantități mari de citokine proinflamatorii, cum ar fi interleukina (IL)-1, IL-6 și factorul de necroză tumorală (TNF) și multe altele. Celulele B produc, de asemenea, autoanticorpi, cum ar fi factorul reumatoid sau anticorpii împotriva peptidelor citrulinate. Toate acestea duc la distrugerea nu numai a membranei sinoviale, ci și a osului și a cartilajului subiacent.22
Biotehnologia în tratamentul artritei reumatoide
Datorită cercetărilor menționate mai sus, a fost dezvoltată și comercializată producția biotehnologică a diferitelor molecule care vizează blocarea unor ținte specifice. Prima generație a fost caracterizată de apariția medicamentelor care neutralizează TNF: etanercept, infliximab și adalimumab și anakinra, care inhibă acțiunea IL-1. Ulterior, au apărut noi molecule, cum ar fi abatacept, pentru a modula costimularea răspunsului imunitar, certolizumab și golimumab pentru a bloca TNF, rituximab împotriva receptorului CD20 al limfocitelor B și tocilizumab care blochează IL-6.7,23-26
În ciuda saltului uriaș în ceea ce privește eficacitatea terapeutică datorat introducerii acestor medicamente, un procent substanțial de pacienți, estimat între 25% și 40%, nu răspund la medicamentele sau produsele biologice comercializate în prezent sau sunt afectați de apariția unor evenimente adverse27.-32 Nevoia de a îmbunătăți această situație rămâne o încurajare în urmărirea și dezvoltarea de noi molecule menite să reglementeze diferite ținte terapeutice care ar putea îmbunătăți eficacitatea terapeutică, cum este cazul abataceptului, care modulează selectiv activarea celulelor T.33
Abatacept este un construct proteic care este produs prin tehnologia ADN-ului recombinant în celule ovariene de hamster.34,35 Această moleculă a fost concepută pentru a interfera cu reglarea căilor costimulatoare din celulele T, care joacă un rol important în patogeneza diferitelor boli autoimune, infecții, respingerea organelor transplantate și imunitatea tumorală.36
Abatacept se utilizează în asociere cu metotrexat la pacienții cu PR care au avut un răspuns inadecvat sau intoleranță la alte DMARD-uri, inclusiv la metotrexat (MTX) sau la un inhibitor al TNF-alfa. În artrita idiopatică juvenilă poliarticulară este indicat la pacienții cu vârsta de 6 ani sau mai mult care au avut un răspuns inadecvat la alte DMARD-uri, inclusiv la cel puțin un medicament care neutralizează TNF. 35
Mecanismul de acțiune al abataceptului
Abataceptul este un modulator selectiv al semnalului costimulator CD80/86-CD28 și, așa cum s-a discutat anterior, este esențial pentru activarea celulelor T Abataceptul inhibă activarea celulelor T, blocând selectiv legarea specifică a receptorului CD80/CD86 din APC la CD28 de pe celulele T (Fig. 2).22,37 Strategia farmacologică urmărește să inhibe răspunsul imunitar/inflamator accelerat, caracteristic bolii, și să restabilească homeostazia normală a sistemului imunitar. De fapt, competiția dintre CD28 endogen și CTLA4 pentru legarea la CD80/86 este mecanismul fiziologic utilizat pentru a regla și, dacă este cazul, a încheia un răspuns imunitar normal. Abatacept, prin blocarea legării CD80/86 la CD28, inhibă transmiterea unui al doilea semnal al răspunsului imunitar, care produce indirect un semnal negativ asupra activării celulelor T. În plus, abataceptul are probabil un efect mai mare în prevenirea formării unui semnal costimulator în celulele T, inactivându-le pe cele deja active, care nu sunt legate de CTLA4
Medicament de susținere a utilizării
1. De ce este inclus abataceptul în grupul de medicamente imunomodulatoare? Practic, pentru că produce depleție celulară, în special a celulelor T datorită acțiunii farmacologice exercitate prin faptul că nu blochează selectiv o anumită citokină, evitând suprimarea radicală a unor căi esențiale pentru buna funcționare a răspunsului imunitar.8
2. Cum împiedică legarea regiunii Fc a moleculei de receptorul său? Regiunea Fc a abataceptului este modificată genetic, astfel încât nu se leagă de receptorii CD16 și CD32 și se leagă foarte slab de receptorul CD64. Această concepție ocolește răspunsurile celulare mediate de receptorul Fc, cum ar fi citotoxicitatea celulară dependentă de anticorpi (ADCC) și citotoxicitatea dependentă de complement (CDC).18 Ambele sunt asociate cu liza celulară, cu potențiale efecte adverse care pot fi observate în cazul tratamentelor cu prolongued38. Prin urmare, fragmentul modificat de IgG1 pare să fie activ, prevenind astfel efectele adverse rezultate din ADCC.39
3. Efectul antiinflamator al abataceptului. Abataceptul reduce semnificativ mulți dintre mediatorii inflamatori la pacienții cu PR, readucându-i la normal, fapt demonstrat în mai multe studii clinice utilizate la cercetarea medicamentului.
Într-un studiu de fază II-b, de 1 an, controlat cu placebo, la pacienți cu PR și răspuns inadecvat la MTX, au fost prelevate probe și au fost măsurate nivelurile serice ale unor markeri selectați în zilele premergătoare perfuziei, pentru a studia efectul abataceptului asupra mediatorilor și citokinelor proinflamatorii. Un grup de pacienți a primit MTX și abatacept 10mg/kg, conform unui program regulat. Grupul de control, între timp, a fost tratat cu MTX și placebo. La un an după tratament, markerii din grupul abatacept de 10mg/kg se normalizaseră, în timp ce au rămas ridicați în grupul placebo (TNF: 7,4 vs 10,3pg/ml; FR: 159 vs 225U/l, sIL-2R: vs 1228,3. 1697,1pg/ml IL-6: 7,3 vs 19,9pg/ml).40
4. Imunogenitatea. Conform datelor privind medicamentul, doar 187 din 3877 (4,8%) pacienți cu PR tratați timp de până la 8 ani cu abatacept au dezvoltat anticorpi împotriva medicamentului în timpul tratamentului.41 Anticorpii împotriva abataceptului au fost evaluați la pacienții după întreruperea tratamentului (>42 de zile de la ultima doză), iar la 103 din 1888 (5,5%) au fost seropozitivi. În schimb, într-un alt studiu efectuat pe 2000 de pacienți abatacept, au fost măsurați anticorpii și s-a concluzionat că abataceptul are o imunogenitate scăzută.42,43
5. Abatacept și tuberculoza. TNF participă la răspunsul inflamator și la imunopatologia tuberculozei (TB). Studiile in vitro arată că TNF crește activitatea fagocitară și micobactericidă a macrofagelor, în timp ce in vivo au fost implicate în formarea inițială și menținerea ulterioară a granuloamelor, ceea ce controlează creșterea micobacteriilor și limitează răspândirea lor. Într-un model cronic de reactivare a tuberculozei latente la șoareci, am studiat evoluția infecției la șoarecii tratați cu abatacept în comparație cu un alt grup tratat cu un anti-TNF monoclonal murin.42 La 4 luni după ce am infectat șoarecii C57BL/6 cu Mycobacterium tuberculosis și, după ce s-a confirmat că au avut o infecție latentă de tuberculoză, șoarecii au fost tratați timp de 16 săptămâni cu una dintre cele două intervenții experimentale. După această perioadă, toți șoarecii tratați cu anti-TNF au murit din cauza tuberculozei diseminate, cu o supraviețuire medie de 44 de zile. Dimpotrivă, niciunul dintre șoarecii tratați cu abatacept nu a murit.
În timp ce concentrația de IFN-g seric nu s-a modificat în grupul cu abatacept, aceasta a fost crescută la șoarecii cu anti-TNF. Această creștere a fost atribuită infiltrației crescute de CD4+ și CD8+ cauzată de dispersia pe scară largă a coloniilor bacteriene.
Atunci, în timp ce șoarecii tratați cu terapie anti-TNF au prezentat o mortalitate de 100%, abataceptul nu a modificat capacitatea șoarecilor de a organiza un răspuns inflamator capabil să controleze răspândirea tuberculozei. Cu toate acestea, nu există încă suficiente date clinice pentru a confirma aceste constatări la om.
6. Efectul antirezorbant al abataceptului asupra remodelării osoase. Activitatea osteoclastelor este crescută în PR, atât la nivelul articulației, determinând eroziuni osoase, cât și la nivel sistemic, atingând niveluri asociate cu osteoporoza generalizată.44,45
De fapt, a fost demonstrată o creștere a ligandului receptor activator al factorului nuclear NF-kB (RANKL) în membrana sinovială.45,46 Abataceptul inhibă în mod dependent de doză formarea osteoclastelor murine și activitatea osteoclastogenică evaluată in vitro. Acest lucru a fost studiat la osteoclastele murine cultivate pe plăci de dentină, care au măsurat numărul de gropi de resorbție după 6 zile de adăugare a diferitelor doze de abatacept.47
Medicamentul a scăzut semnificativ suprafața de resorbție osoasă. Aceste date sugerează că abataceptul este o moleculă care se leagă direct de celulele precursoare ale osteoclastelor, inhibând diferențierea acestora. Acest mecanism ar putea explica efectul antieroziv al medicamentului la pacienții cu PR. De fapt, pacienții tratați cu abatacept au prezentat o tendință de scădere a nivelurilor de RANK și a ligandului său RANKL în sinovială, toate acestea fiind asociate cu o creștere a osteoprotegerinei. 48 Deși mecanismul exact care stă la baza acestei observații nu este clar, aceste constatări se corelează bine cu ameliorarea radiologică observată la pacienții tratați cu abatacept.
7. Efectele abataceptului în alte celule imune. Deși APC este celula țintă care se leagă de abatacept și macrofagele exprimă, de asemenea, receptori CD80/86 pe suprafața lor, există puține studii care să investigheze acțiunea medicamentului asupra activității acestor celule. Într-adevăr, un studiu in vitro recent a arătat că macrofagele prezintă o expresie marcată a receptorilor CD80/86, iar tratamentul cu abatacept a redus substanțial producția de citokine49 . Aceste rezultate sugerează că mecanismul de acțiune al medicamentului ar putea fi extins la reglarea liniei macrofagelor, celule cheie în patogeneza bolii.
Abataceptul suprimă, de asemenea, migrația foliculară a celulelor T specifice antigenului și, în consecință, colaborarea dintre celulele T și celulele B foliculare din ganglionul limfatic. Această constatare a fost observată in situ în ganglionii limfatici ai șoarecilor BALB/c50. După transfuzia unor astfel de șoareci cu celule T prestimulate specifice antigenului, o imunizare ulterioară a șoarecilor a arătat proliferarea și migrarea celulelor T către zona limfocitelor B. La șoarecii tratați cu abatacept, proliferarea și migrația celulelor T au fost blocate, limitând prezența acestora în majoritatea cazurilor în paracortexul ganglionilor limfatici. Astfel, tratamentul prelungit cu abatacept reduce proliferarea, mobilitatea și distribuția limfocitelor cu memorie autoantigenă intraganglionară, ceea ce ar putea duce la scăderea autoanticorpilor.
Concluzii privind mecanismul de acțiune al abataceptului
Abatacept este o construcție proteică complet umanizată, formată din domeniul extracelular al antigenului 4 asociat limfocitelor T citotoxice umane (CTL4) și un fragment modificat genetic al regiunii Fc a IgG1, conceput pentru a interfera cu reglarea costimulării limfocitelor T Medicamentul inhibă activarea celulelor T prin blocarea selectivă a legării specifice a CD80/CD86 la receptorul CD28 și, prin urmare, prin inhibarea proliferării celulelor T și a răspunsurilor imune ale limfocitelor B Această acțiune farmacologică are ca rezultat scăderea nivelurilor mediatorilor inflamatori la pacienții cu PR și un răspuns clinic sigur și eficient.
Conflict de interese
Dr. Gabriel Herrero-Beaumont a primit granturi de cercetare de la Bristol-Myers-Squibb. Dr. Santos Castañeda a primit subvenții pentru educație și cercetare de la Abbott, MSD și Pfizer.
.