A: Definition av surhetskonstanten
Du är säkert medveten om att vissa syror är starkare än andra. Den relativa surheten hos olika föreningar eller funktionella grupper – med andra ord deras relativa förmåga att avge en proton till en gemensam bas under identiska förhållanden – kvantifieras av ett tal som kallas surhetskonstanten, förkortat Ka. Den gemensamma basen som valts för jämförelsen är vatten.
Vi kommer att betrakta ättiksyra som vårt första exempel. Om vi gör en utspädd lösning av ättiksyra i vatten uppstår en syra-basreaktion mellan syran (protondonator) och vattnet (protonacceptor).
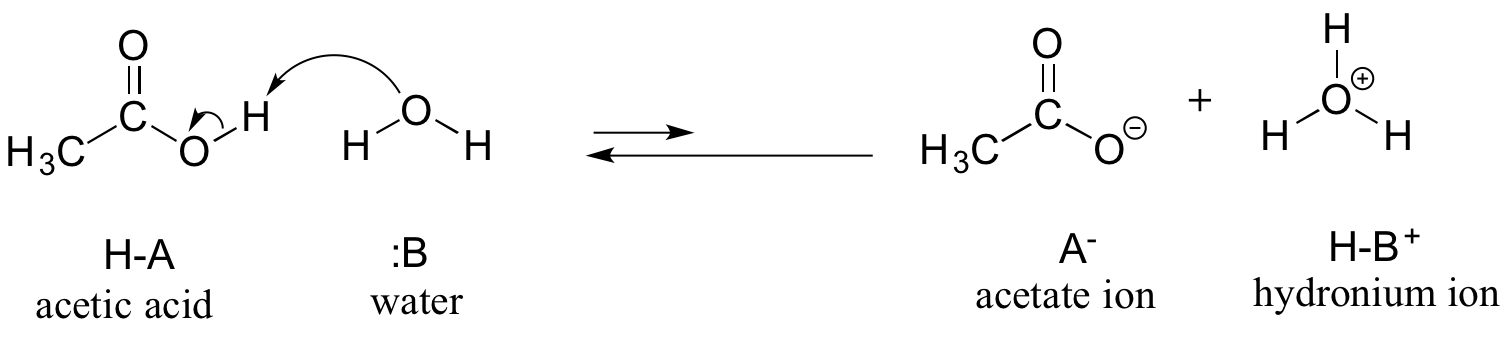
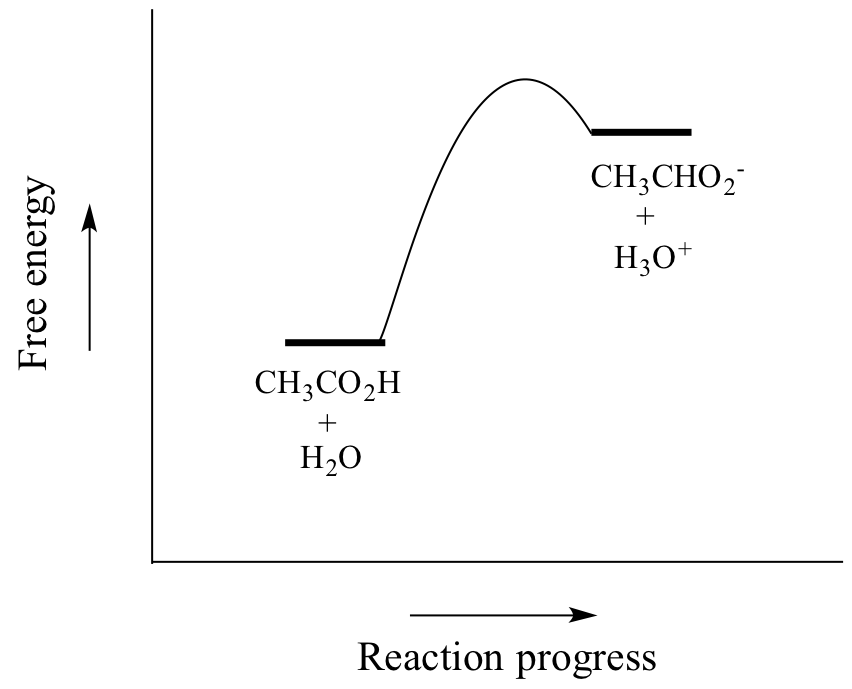
Ättiksyra är en svag syra, så jämvikten gynnar reaktanterna framför produkterna – det är termodynamiskt ”uppåt”, vilket indikeras i figuren ovan av den relativa längden på pilarna för den framåtriktade och den bakåtriktade reaktionen, och i reaktionskoordinatdiagrammet nedan där produkterna har högre energi än reaktanterna.
Som ni vet definieras jämviktskonstanten Keq som:
![]()
Alla uttryck för jämviktskonstanter är i själva verket en kvot mellan aktiviteterna hos alla arter som deltar i reaktionen. För att undvika användningen av aktiviteter, och för att förenkla experimentella mätningar, approximerar koncentrationernas jämviktskonstant aktiviteterna hos lösta ämnen och gaser i utspädda lösningar med deras respektive molariteter. Aktiviteterna hos fasta ämnen, rena vätskor och lösningsmedel approximeras dock inte med deras moläritet. Istället definieras dessa aktiviteter så att de har ett värde som är lika med 1 (ett).
Om vi alltså erkänner att vattnets aktivitet i en utspädd lösning approximeras med värdet ett (1), kan vi dividera med 1 för att få den vanliga formen av uttrycket för Ka, syrakonstanten för ättiksyra:
\}{(1)} = \dfrac{}{} \]
För en utspädd vattenlösning kan vattnets aktivitet approximeras med värdet 1, så den generiska dissociationskonstanten för en given syra HA eller HB+ uttrycks som:
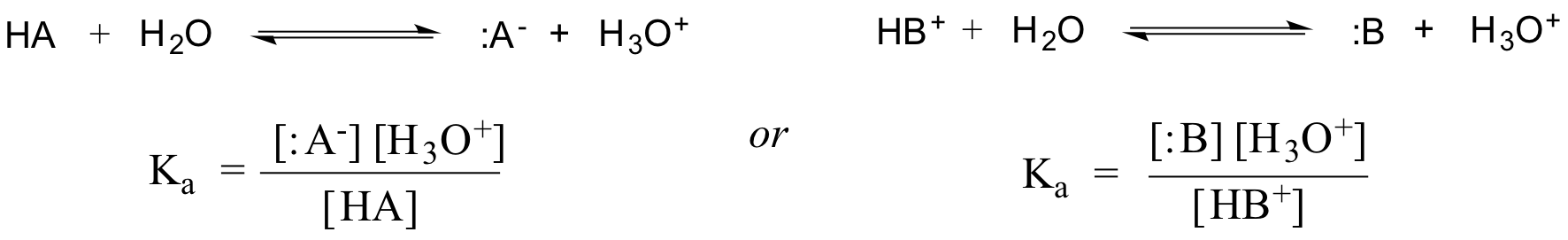
Värdet för Ka för ättiksyra är 1.75 x 10-5 – mycket mindre än 1, vilket tyder på att det finns mycket mer ättiksyra i lösningen vid jämvikt än acetat- och hydroniumjoner.
Omvänt genomgår svavelsyra, med ett Ka på cirka 109, eller saltsyra, med ett Ka på cirka 107, båda i princip fullständig dissociation i vatten: de är mycket starka syror.
En siffra som 1,75 x 10- 5 är inte särskilt lätt vare sig att säga, komma ihåg eller visualisera, så kemister brukar använda en bekvämare term för att uttrycka relativ surhet. En syras pKa-värde är helt enkelt log (bas 10) av dess Ka-värde.
pKa = -log Ka Ka = 10-pKa
Om vi räknar på det får vi reda på att ättiksyrans pKa är 4,8. Svavelsyrans pKa är -10 och saltsyrans pKa är -7. Användningen av pKa-värden gör det möjligt att uttrycka den relativa surheten hos vanliga föreningar och funktionella grupper på en numerisk skala från cirka -10 (för en mycket stark syra) till 50 (för en förening som inte är sur alls). Ju lägre pKa-värdet är, desto starkare är syran.
De joniserbara (protonavgivande eller protonacceptans) funktionella grupper som är relevanta för biologisk organisk kemi har i allmänhet pKa-värden som sträcker sig från ca 5 till ca 20. De viktigaste av dessa sammanfattas nedan, med mycket grova pKa-värden för de konjugerade syraformerna. Mer sura grupper med pKa-värden nära noll finns också med som referens.
Omständliga pKa-värden att känna till
hydroniumjon (H3O+) : 0
protonerad alkohol: 0
protonerad karbonylering: 0
karboxylsyror: 5
protonerade iminer: 7
protonerade aminer: 10
fenoler: 10
tioler: 10
vatten: 14
alkoholer: 15-18
alfa-kolsyra*: 20
*alfa-kolsyror kommer att diskuteras senare i detta kapitel
Du rekommenderas starkt att memorera dessa grova värden nu – om du sedan behöver ett mer exakt värde kan du alltid slå upp det i en pKa-tabell.
Försiktighet! pKa är inte samma som pH!
Det är viktigt att inse att pKa inte är samma sak som pH: den förstnämnda är en inneboende egenskap hos en förening eller funktionell grupp, medan den sistnämnda är ett mått på koncentrationen av hydroniumjoner i en given vattenlösning:
pH = -log
Med kännedom om pKa-värdena kan vi inte bara jämföra syrastyrka, utan även basstyrka. Den viktigaste idén att komma ihåg är följande: ju starkare den konjugerade syran är, desto svagare är den konjugerade basen. Vi kan avgöra att hydroxidjonen är en starkare bas än ammoniak (NH3), eftersom ammoniumjonen (NH4+, pKa = 9,2) är en starkare syra än vatten (pKa = 14,0).
Övningsuppgift 7.2.1
Vilken är den starkare basen, CH3O- eller CH3S-? Acetatjonen eller ammoniaken? Hydroxidjon eller acetatjon?
Lösning
Låt oss använda vår förståelse av pKa-begreppet i samband med en mer komplex molekyl. Till exempel, vad är pKa för föreningen nedan?
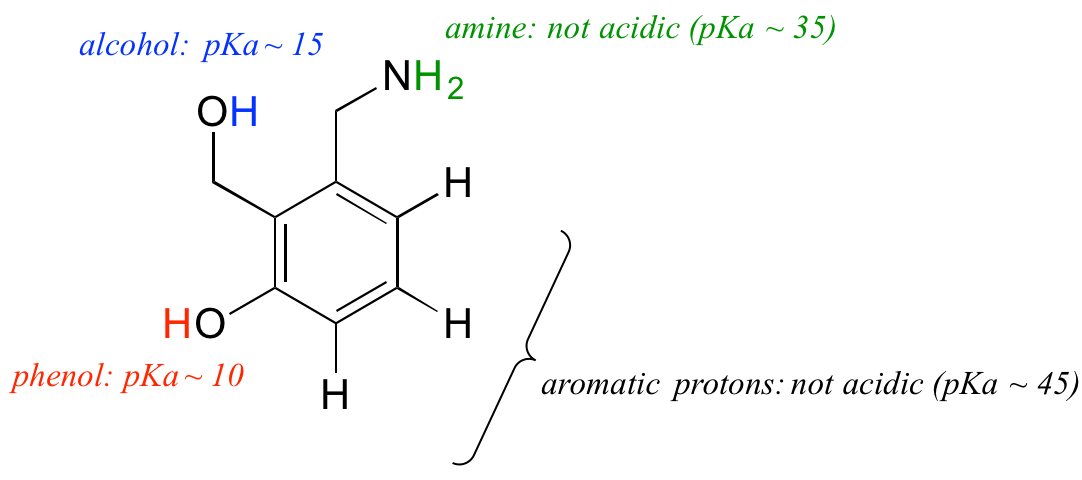
Vi måste utvärdera den potentiella surheten hos fyra olika typer av protoner på molekylen och hitta den mest sura. De aromatiska protonerna är inte alla sura – deras pKa är ungefär 45. Amingruppen är inte heller sur, dess pKa är ungefär 35. (Kom ihåg att oladdade aminer är basiska: det är positivt laddade protonerade aminer, med pKa-värden runt 10, som är svagt sura.) Alkoholprotonen har en pKa på cirka 15 och fenolprotonen har en pKa på cirka 10: den mest sura gruppen på molekylen ovan är alltså fenolen. (Se till att du kan känna igen skillnaden mellan en fenol och en alkohol – kom ihåg att i en fenol är OH-gruppen bunden direkt till den aromatiska ringen). Om denna molekyl skulle reagera med en molär ekvivalent av en stark bas som t.ex. natriumhydroxid är det fenolprotonen som skulle doneras för att bilda en fenolatanjon.
Övningsuppgift 7.2.2
Identifiera den mest sura funktionella gruppen på var och en av molekylerna nedan och ange dess ungefärliga pKa.

Lösning
.