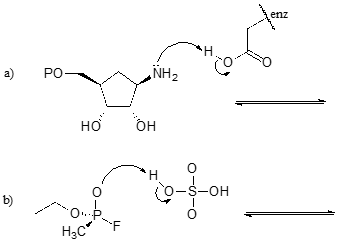
Brønsted-Lowry-definitionen av surhet och basiskhet
Vi börjar vår diskussion om syra-bas-kemi med ett par viktiga definitioner. Den första av dessa föreslogs 1923 av den danske kemisten Johannes Brønsted och den engelske kemisten Thomas Lowry och har kommit att kallas Brønsted-Lowry-definitionen av surhet och basiskhet. Enligt Brønsted-Lowry-definitionen är en syra en art som fungerar som protongivare, medan en bas är en protonacceptor. Vi har redan i föregående kapitel diskuterat ett av de mest kända exemplen på en Brønsted-Lowry syra-basreaktion, mellan saltsyra och hydroxidjon:
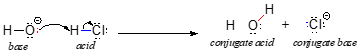
I denna reaktion överförs en proton från HCl (syran, eller protongivaren) till hydroxidjonen (basen, eller protonacceptorn). Som vi lärde oss i föregående kapitel visar böjda pilar elektronernas rörelse i denna bindningsbrytande och bindningsbildande process.
När en Brønsted-Lowry-syra donerar en proton kallas det som återstår för den konjugerade basen. Kloridjonen är således den konjugerade basen till saltsyra. Omvänt, när en Brønsted-Lowry-bas tar emot en proton omvandlas den till sin konjugerade syraform: vatten är således hydroxidjonens konjugerade syra.
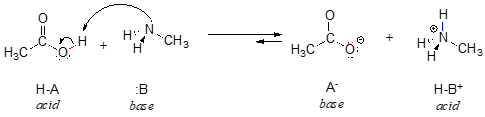
Här är en organisk syra-basreaktion, mellan ättiksyra och metylamin:
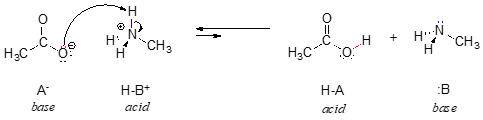
I den omvända reaktionen är acetatjonen basen och metylammoniumjonen (protonerat metylamin) syran.
Vad gör att en förening blir sur (sannolikt att donera en proton) eller basisk (sannolikt att acceptera en proton)? Att besvara den frågan är en av våra huvuduppgifter i det här kapitlet och kommer att kräva att vi använder oss av mycket av det vi lärt oss om organisk struktur i de två första kapitlen, liksom de idéer om termodynamik som vi gick igenom i kapitel 6.
För tillfället ska vi bara ta hänsyn till en gemensam egenskap hos baser: för att kunna fungera som bas måste en molekyl ha ett reaktivt elektronpar. I alla syra-basreaktioner som vi kommer att se i det här kapitlet har den basiska arten en atom med ett ensamt elektronpar. När metylamin agerar som bas, till exempel, används det ensamma elektronparet på kväveatomen för att bilda en ny bindning till en proton.
Det är uppenbart att metylammoniumjonen inte kan agera som bas – den har inte ett reaktivt elektronpar med vilket den kan ta emot en proton.
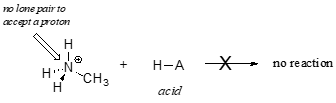
Senare, i kapitel 14, kommer vi att studera reaktioner där ett elektronpar i en bindning i en alken eller aromatisk ring agerar på ett basiskt sätt – men för tillfället kommer vi att koncentrera oss på basiskheten hos icke-bindande (lone pair) elektroner.
Övningsuppgift \(\PageIndex{1}\)
Fullborda nedanstående reaktioner – med andra ord, rita strukturer för de konjugerade syror och konjugerade baser som saknas och som är resultatet av de böjda pilarna.