Med tanke på DNA:s relativa strukturella enkelhet och repetitivitet skulle det följa att proteiner som binder specifikt till det skulle kunna ha gemensamma DNA-bindande domänmotiv men med specifika aminosyror i sidokedjor som möjliggör specifika bindningsinteraktioner.
- helix-turn-helix: finns i prokaryotiska DNA-bindande proteiner.
Figur: helix-turn-helix
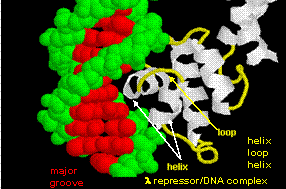
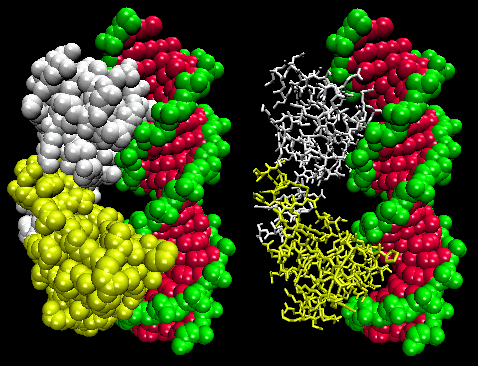
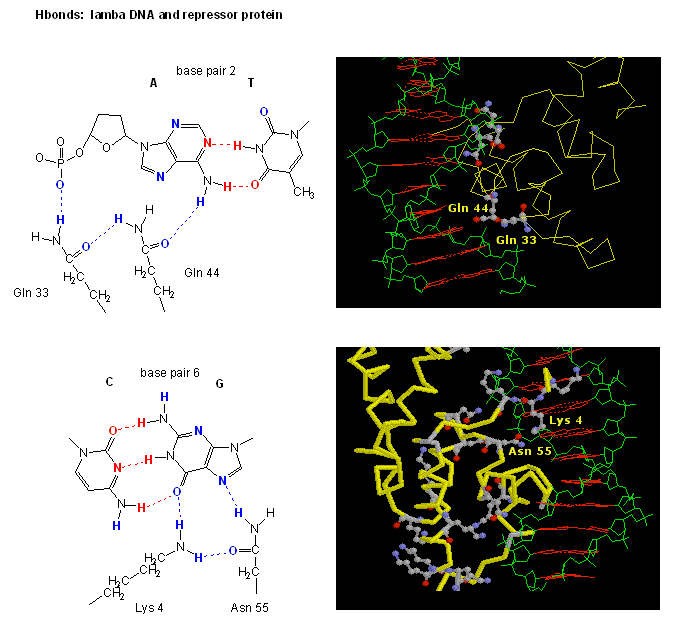
Figurerna visar två sådana proteiner, cro-repressorn från bakteriofag 434 och lambda-repressorn från bakteriofag lambda. (Bakteriofager är virus som infekterar bakterier.) Lägg märke till hur specificiteten delvis uppnås genom bildandet av specifika H-bindningar mellan proteinet och den stora lunden i operatörs-DNA:t.
Figur: Lambda Repressor/DNA-komplex
Figur: H-bindningsinteraktioner mellanλ-repressor och DNA
![]() Jmol: Uppdaterad Lambda Repressor/DNA-komplex Jmol14 (Java) | JSMol (HTML5)
Jmol: Uppdaterad Lambda Repressor/DNA-komplex Jmol14 (Java) | JSMol (HTML5)
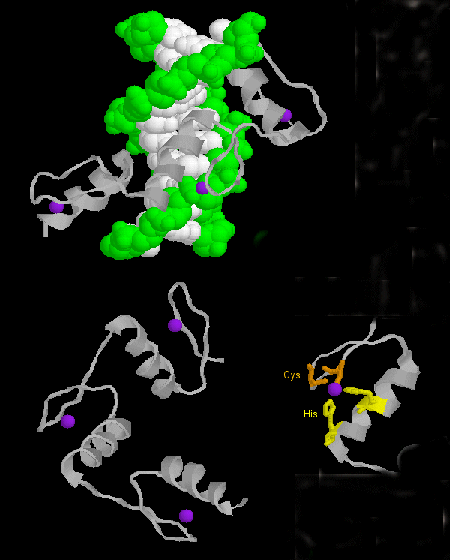
- zinkfinger: (eukaryoter) Dessa proteiner har ett gemensamt sekvensmotiv av X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4- där X är en valfri aminosyra. Zn2+ är tetraedriskt koordinerat med Cys- och His-sidekedjorna, som befinner sig på en av två antiparallella betasträngar respektive en alfahelix. Zinkfingret, som stabiliseras av zinken, binder till DNA:s stora spår. ]
Figur: Zinkfinger
![]() Jmol: Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
Jmol: Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
Zinkfingerproteiner, varav 900 är kodade i den mänskliga arvsmassan (inklusive det eukaryotiska isolatorbindande proteinet CTCF som beskrivs ovan) kan mobiliseras för att faktiskt reparera specifika mutationer i celler, vilket, om det utförs i en tillräckligt hög procentandel av de muterade cellerna, skulle kunna bota specifika genetiska sjukdomar, t.ex. vissa former av svår kombinerad immunbristsjukdom. I denna nya teknik (Urnov et al., 2005) kopplas flera länkade Zn-finger-bindningsdomäner (en av de naturligt förekommande eller muterade former som framställts i laboratoriet), var och en specifik för en viss nukleotidsekvens, till ett ospecifikt endonukleas som härrör från enzymet FokI. Nukleaset är aktivt i dimerisk form, så det aktiva komplexet kräver två endonukleasdomäner, var och en bunden till fyra olika Zn-fingerdomäner, för att samlas på målplatsen. Bindningens specificitet uppnås genom selektion av Zn-fingerdomänerna. Nukleaset gör sedan en nick i DNA:t och värdcellens reparationsmekanismer följer. Denna process inbegriper separation av strängen, homolog rekombination av den skadade regionen med komplementärt DNA i cellen och reparation av skadan. Om ett överskott av vildtyp-DNA (icke-muterat) läggs till i cellerna och används som mall, skulle den normala DNA-reparationsmutationen åtgärda mutationen. Urnov et al har visat att upp till 20 % av odlade celler som innehåller en mutation kan repareras i laboratoriet. Om dessa celler får en selektiv tillväxtfördel skulle de muterade cellerna så småningom ersättas med celler av vildtyp.
- steroidhormonreceptorer: (eukaryoter) Till skillnad från de flesta hormoner, som binder till receptorer på cellytan, passerar steroidhormoner (kolesterolderivat) genom cellmembranet och binder till cytoplasmatiska receptorer genom en hormonbindande domän. Detta ändrar formen på receptorn som sedan binder till en specifik plats på DNA (hormonresponselementet) genom en DNA-bindningsdomän. I en struktur som är analog med zinkfingret är Zn 2+ tetraedriskt koordinerat till 4 Cys i en globulärliknande struktur som binder som en dimer till två identiska, men omvända sekvenser av DNA (palindrom) inom den stora groven. (Exempel på palindromer: Jag var kapabel innan jag såg Elba; Dennis och Edna åt middag, sa jag, medan Enid och Edna syndade.
Konsultera glukokortikoidreceptorn (GR) som ett specifikt exempel. Den binder DNA som en dimer. Dimerens två DNA-bindningsdomäner associerar sig med två intilliggande stora spår av DNA i GR-bindningssekvensen (GBS), en kort DNA-sekvens inom promotorn. Meijsing, et al. har funnit att GBS inte bara fungerar som en bindningsplats för GR, vilket möjliggör transkription av gener, utan att den också påverkar receptorns konformation, vilket gör att genernas transkription regleras på ett annat sätt. Gruppen konstruerade luciferas-”rapportörgener” som har GBS kopplat till genen för proteinet luciferas, som skulle uttrycka proteinet luciferas (som fluorescerar) om de transkriberades, med GBS. De fann att den relativa transkriptionella aktiviteten inte korrelerade med den relativa bindningsaffiniteten hos GR till GBS. GBS som var mycket mer aktiva än andra band på ett jämförbart sätt med dem med lägre aktivitet, medan GBS med liknande transkriptionell aktivitet band med olika affinitet. Detta visar att GBS ger en unik funktion till den GR som är associerad med den (dvs. transkriptionen påverkas inte bara av om GR är bunden till GBS eller inte). Det visade sig att en �hävarm� av receptorn genomgår konformationsförändringar när den är bunden till DNA, med förändringar som är specifika för den sekvens som den var bunden till. Ett mutantprotein, GR-γ, gjordes så att det var identiskt med vildtypsproteinet, GR-α, med undantag för hävstångsarmen visade sig ha olika transkriptionsaktivitet trots att de band till samma plats på DNA, vilket visar att hävstångsarmen och dess konformation påverkar transkriptionen.
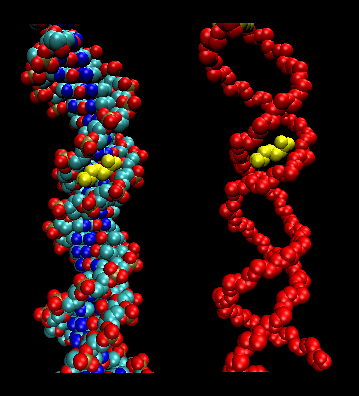
- leukinblixtlås (eller saxar): (Eukaryoter) Dessa proteiner innehåller sträckor med 35 aminosyror där Leu återfinns upprepade gånger med 7 aminosyraintervall. Dessa områden av proteinet bildar amfifila spiraler, med Leu på ena sidan, en Leu efter två varv av en spiral. Två av dessa proteiner kan bilda en dimer som stabiliseras genom att dessa opolära, leucinrika amfifila spiraler binds till varandra och bildar en spiral, ungefär som i muskelproteinet myosin. Leucinblixtlåset representerar proteinets proteinbindningsdomän. DNA-bindningsdomänen finns i de första 30 N-terminala aminosyrorna, som är basiska och bildar en alfahelix när proteinet binder till DNA. Leucinzippet fungerar sedan för att föra samman två DNA-bindande proteiner, vilket gör det möjligt för de N-terminala bashelikerna att interagera med DNA:s stora lund på ett basspecifikt sätt. Valin och isoleucin, tillsammans med leucin, finns ofta i sträckor av aminosyror som kan interagera för att bilda andra typer av spiraler.
Figur: leucinblixtlås (gjort med VMD)
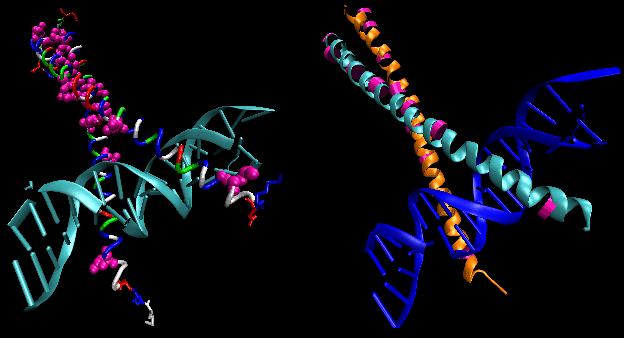
![]() Jmol: Jmol14 (Java) | JSMol (HTML5)
Jmol: Jmol14 (Java) | JSMol (HTML5)
Precis som zinkfingernukleaser har använts för att framkalla reparation av mutationer, användes i en annan studie av råttgenomet specialdesignade ZFN:er för att orsaka brott i ds-DNA som innehöll mutationer från en felaktig DNA-reparationsmekanism (genom NHEJ) och som därmed innehöll specifika mutationer (Geurts, et al. 2009). Denna process, �knockout av genen,� förhindrar produktionen av det protein som normalt transkriberas av målgenen. Fem- och sexfingriga ZFN:er användes för att uppnå en hög grad av specificitet i den riktade bindningen till genen för tre olika proteiner: grönt fluorescerande protein (GFP), immunoglobulin M (IgM) och Rab38. Knockoutningen lyckades hos 12 % av de testade råttorna; dessa djur hade inget protein av vildtyp och inget uttryck. ZFN:erna var tillräckligt specifika för att inga mutationer observerades på någon av de 20 förutspådda icke-målplatser. Denna studie stöder livskraften hos kontroll av transkription och uttryck för behandling av sjukdomar och vikten av specifik bindning.
Vi har sett att två huvudfaktorer bidrar till proteiners specifika igenkänning av DNA; bildandet av vätebindningar till specifika nukleotiddonatorer och -acceptorer i det stora spåret och sekvensberoende deformationer av DNA-helixen till förändrade former med ökad affinitet för proteinligander. Tata Binding Protein (TBP) kan t.ex. interagera med en breddad mindre spår i TATA-boxen. Nya rön stöder att proteiner dessutom kan använda information i mindre spår som har blivit ”smalare” beroende på nukleotidsekvensen.
DNA-spår som är berikade med A kan leda till vridkonformationer som orsakar vätebindning mellan basparen i de större spåren, vilket resulterar i en smalare mindre spår. Stora mängder AT-baspar är koncentrerade i smala mindre spår (bredd <5,0 �) och CG-baspar finns oftare i breda mindre spår.
Hur påverkar förträngning av mindre spår DNA-igenkänning? Smala minor groves ökar DNA:s negativa elektrostatiska potential, vilket gör det till en mer specifik och igenkännbar plats. DNA:s ryggradsfosfater befinner sig närmare spårets mitt när det är smalt, vilket korrelerar smala minor grooves med en mer negativ elektrostatisk potential.
De delar av proteiner som interagerar med minor grove innehåller arginin vars sidokedja kan rymmas i den smalare och mer negativa minor groove. Argininer kan binda och i vissa fall infoga sig själva som korta sekvensmotiv som ökar specificiteten hos DNA:s formigenkänning. Arg är att föredra framför Lys eftersom den effektiva radien för laddningen i Arg är större än för laddningsbäraren i Lys. Detta skulle leda till en minskad desolvationsenergi för Arg, vilket skulle främja dess bindning till den förträngda huvudfåran. Denna upptäckt visar att ”DNA-formens roll måste beaktas när man annoterar hela genomet och förutspår bindningsställen för transkriptionsfaktorer”.
Figur: Arg i T3c Transposase-bindning i smal mindre lund av T3c Transposon
- Sliding Model for protein/DNA Interactions
Contributors and Attributions
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)