- Introduktion
- Material och metoder
- Material och kemikalier
- Förberedelse av cellinjer
- Zebrafiskberedning
- Cellviabilitetsanalys och morfologisk observation
- Apoptosanalys genom DAPI-färgning och flödescytometri
- Xenograft Animal Assay
- Real Time PCR (qPCR)-analys
- Western Blot (WB)-analys
- Statistisk analys
- Resultat
- Antiproliferativ effekt av TF
- Pro-apoptotisk effekt av TF
- In Vivo Effect of TF on Xenograft Zebrafishes
- Molekylär verkan av TF på mRNA-uttryck i A375-celler
- Molekylär verkan av TB på proteinexpressioner i A375-celler
- Diskussion
- Slutsats
- Data Availability Statement
- Etikutlåtande
- Författarbidrag
- Finansiering
- Intressekonflikt
- Abkortningar
Introduktion
Melanom är en dödlig typ av hudcancer med hög metastaserande potential och svårlöst (Yang et al., 2018). Melanompatienter i avancerade stadier är alltid oskadliga och har en sämre prognos (Leonardi et al., 2018). Kemoterapi är en grundpelare i den kliniska behandlingen av melanom, men kemoterapeuternas effektivitet är begränsad på grund av deras biverkningar på friska vävnader (Oliveira Pinho et al., 2019). Nyligen har flera immunterapier, inklusive CTLA-4- eller PD-1-receptorhämmare, utvecklats som nya alternativ för behandling av melanom, men deras effektivitet är otillförlitlig och deras biverkningar är fortfarande inte försumbara (Rodríguez-Cerdeira et al., 2017). Därför behövs det snarast nya strategier med tillfredsställande effektivitet och säkerhet. Traditionell kinesisk medicin (TCM) är en kompletterande strategi och har tillämpats kliniskt i tusentals år och besitter viss effektivitet och färre biverkningar. Enligt TCM-teorin är cancer förknippad med kroppens ackumulering av slem, gifter eller inflammation, och de anti-flegmatiska, anti-toxiska eller anti-inflammatoriska örterna kan besitta anti-cancereffekter (Wang och Cheng, 2019). Teorin har fått stöd av många fall. Till exempel utövade curcumin i Rhizoma Curcumae longae cytotoxiska effekter genom att inducera apoptos och hämma angiogenes av melanomceller (Mirzaei et al., 2016), och vitexin i Vitex negundo undertryckte melanomcellstillväxten genom att inducera DNA-skador och öka ROS-nivåerna (Liu et al., 2018). Därför har TCM:s växtbaserade komponenter stor potential för behandling av cancer, såsom melanom.
Tee är en av de mest förekommande dryckerna i världen. Den är välkänd inte bara för den säregna smaken utan också för fördelarna för hälsan. På grund av de olika processerna har te tre huvudtyper, bland annat ojäst grönt te, delvis jäst oolongte och helt jäst svart te eller pu-erh-te (Kuo et al., 2005). Teblad har karaktäriserats som en TCM- ört med anti-flegma och antitoxiska egenskaper, vilket tyder på dess potential mot cancer. Moderna studier har rapporterat att tedryck är effektivt för att förebygga och behandla cancer (Jin et al., 2018). Nyligen har tepolyfenoler visat sig ha anti-canceraktivitet, vilket har överlägsen effekt på tedryck (Mao et al., 2019). Teaflavin (TF) är en sådan polyfenolkomponent som produceras genom oxidation av katekiner i teblad under fermentering och fungerar som ett huvudpigment för teets färg, smak och bioaktivitet (Roberts et al., 1957). Den kan inducera apoptos i en mängd olika cancercellinjer, såsom humana bröstkarcinomcellinjer (MCF-7, MDA-MB-231, T47D och ZR-75-1), kolonkarcinomcellinjer (HCT-15 och HT-29) och leverkarcinomcellinjer (HCCLM3 och Huh-7), vilket tyder på en anti-cancerpotential (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Trots detta har dess effekt mot melanom ännu inte uppmärksammats särskilt mycket.
Med tanke på de rapporterade pro-apoptotiska effekterna av TF på många cancercellinjer (Lahiry et al., 2008), har vi lagt fram en hypotes om att TF utövar pro-apoptotiska effekter på melanomceller. För att verifiera detta utförde föreliggande in vitro-experiment för att utvärdera den cytotoxiska pro-apoptotiska effekten av TF på humana melanomceller och genomförde in vivo-experiment genom att använda en xenograftmodell i larviga zebrafiskar för att bestämma dess tumörhämmande effekt. Dessutom undersöktes också TF:s mekanism.
Material och metoder
Material och kemikalier
Theaflavin (TF, >95% renhet) tillhandahölls av Theabio Co., Ltd (Hangzhou, Kina) (Batchnummer: 20181211061). Dulbecco′s modified Eagle′s medium (DMEM) med hög glukoshalt (4,5 g/l) erhölls från HyClone Laboratories (UT, USA). Fetalt bovint serum (FBS) erhölls från Cell Max (Beijing, Kina). Trypsin (0,25 %) erhölls från Gibco (NY, USA). 3-(4,5-dimetylthiazol-2-yl)-2,5-difenyltetrazoliumbromid (MTT) och dimetylsulfoxid (DMSO) kom från Sigma (St. Louis, MO, USA). Annexin-V: FITC-kit för upptäckt av apoptos erhölls från BD Biosciences (CA, USA). 4′-6-diamidino-2-phenylindol (DAPI) färgningslösning erhölls från Thermo Fisher Scientific (MA, USA). Primära antikroppar erhölls från Cell Signaling Technology (MA, USA). Trizolreagens och kit för realtidspolymeraskedjereaktion (realtids-PCR) erhölls från TaKaRa (Dalian, Kina).
Förberedelse av cellinjer
Human HFF-1 hudfibroblast och A375 melanomcellinje erhölls från Shanghai Cell Bank of Chinese Academy of Sciences (Shanghai, Kina), och mänsklig A875 melanomcellinje erhölls från Kunming Cell Bank of Chinese Academy of Sciences (Kunming, Kina). Dessa cellinjer odlades i DMEM-medium som innehöll 10 % FBS vid 37 °C i en fuktig inkubator med 5 % koldioxid. Mediet byttes dagligen och cellerna behandlades med TF i sin logaritmiska tillväxtfas.
Zebrafiskberedning
Zebrafiskstam av vildtyp AB erhölls från China Zebrafish Resource Center, Institute of Hydrobiology, China Academy of Science (Wuhan, Kina) och ackrediterades av Association for Assessment and Accreditation of Laboratory Animal Care International (SYXK 2012-0171). Larviga zebrafiskar vid 2 dpf (dagar efter befruktning) producerades genom naturlig parning och hölls i en ljuskontrollerad vattenbruksanläggning med en standardfotoperiod på 14:10 h dag/natt och utfodrades med levande saltvattenräkor två gånger om dagen och yngelflingor en gång om dagen.
Cellviabilitetsanalys och morfologisk observation
MTT-analyser utfördes för att bestämma de hämmande effekterna av TF på melanomcellinjer, enligt tidigare beskrivning (Zhou et al, 2017). Celler såddes i 96-well-plattor med 6×103 celler/brunn i 200 μl medium för 24 timmars vidhäftning, följt av behandling med TF i koncentrationerna 0, 50, 100, 150, 200, 250, 300 och 400 μg/ml i 24, 48 och 72 timmar. 20 μl MTT-lösning (5,0 mg/ml) tillsattes sedan till varje brunn och inkuberades vid 37 °C i 4 timmar. DMSO (150 μl) tillsattes i varje brunn och det optiska densitetsvärdet (OD-värdet) mättes vid 490 nm med Biorad-mikroplattläsare (CA, USA). Inhibitionsgrad (%) = × 100 %. De 50 % inhiberande koncentrationerna (IC50) för 24, 48 och 72 timmar beräknades genom regressionsanalys. Följaktligen betecknades 120, 240 och 360 μg/ml (232,3, 464,7 och 697,0 μM) som låga, mellersta och höga doser av TF. Därefter såddes HFF-1-, A375- och A875-cellinjerna i 96-well-plattor enligt ovan och behandlades med medelhög dos av TF vid 24 h. Cellmorfologin hos A375-cellerna observerades i Carl Zeiss fluorescensmikroskop (Göttingen, Tyskland).
Apoptosanalys genom DAPI-färgning och flödescytometri
Cellapoptos bestämdes genom DAPI-färgning och annexin-V/PI-färgning baserad flödescytometri. För DAPI-färgning såddes A375-celler i 96-hålsplattor och behandlades med TF i låga, medelhöga och höga koncentrationer i 24 timmar, följt av fixering med 4 % paraformaldehyd i PBS i 30 minuter i rumstemperatur och färgning med DAPI i 10 minuter i mörker. Efter tre tvättar observerades cellerna med hjälp av fem täckglas under Carl Zeiss fluorescensmikroskop (Göttingen, Tyskland) och de apoptotiska cellerna räknades. Flödescytometri utfördes enligt tillverkarens instruktioner. Kortfattat: A375-celler såddes i 6-hålsplattor med 3×105 celler/brunn i 24 timmar och behandlades med TF i låga, medelhöga och höga koncentrationer i ytterligare 48 timmar. Därefter tvättades cellerna två gånger och märktes med annexin V-fluorescein-isotiocyanatlösning och PI i bindningsbuffert. Cellernas fluorescensintensitet registrerades med BD C6 flödescytometri (CA, USA). Analysen replikerades och de tidiga apoptotiska och sena apoptotiska cellfrekvenserna (%) beräknades.
Xenograft Animal Assay
För att bestämma dosintervallet för TF användes totalt 300 larviga zebrafiskar vid 3 dpf och odlades slumpmässigt i 6-brunnsplattor med 30 fiskar vardera. TF löstes upp i varje brunn med 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1 000 respektive 2 000 μg/ml i 24 timmar. Därefter observerades fiskarna i varje grupp i ett stereoskopiskt mikroskop för att registrera dödlighet och biverkningar. I enlighet med vår tidigare studie uppskattades NOAEL-nivån (no observed adverse effect level) för TF, och 1/9 NOAEL, 1/3 NOAEL och NOAEL användes som låga, medelhöga och höga doser för följande experiment (Jin et al, 2018).
För att etablera xenograftmodellen färgades A375-celler med CM-Dil (röd fluorescens) i en utspädning på 1:1 000 och mikroinjicerades i gulesäcken hos larviga zebrafiskar (2 dpf) i en dos på 200 celler/fisk. Efter tumörtillväxt i 24 timmar observerades alla fiskar i ett fluorescerande mikroskop (AZ100, Nikon, Tokyo, Japan) för modellverifiering. De A375-bärande fiskarna delades in i 5 grupper (30 fiskar vardera) och behandlades med 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL och NOAEL av TF samt 15 μg/ml (50 μM) cisplatin i 24 h. Fluorescensintensiteten (FI) av A375-cellmassan hos zebrafiskar detekterades och inhiberingsgraden beräknades enligt följande: inhiberingsgrad (%) = × 100 %.
Real Time PCR (qPCR)-analys
För att avslöja TF:s molekylära verkan på A375-celler användes qPCR på ett ABI QuantStudio™ 7 Flex Real-Time PCR-system (Applied Biosystems, CA, USA). Det totala RNA från A375-celler extraherades med Trizol-reagens och syntetiserades till cDNA via omvänd transkription. qPCR-reaktionssystemet hade en volym på 20,0 μl: 10 μl SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl PCR forward primer, 0,8 μl PCR reverse primer, 2,0 μl template cDNA, 0,4 μl ROX referensfärgämne och 6,0 μl ddH2O. Reaktionsförhållandena för qPCR-reaktionen fastställdes till 95 °C för 30 s inledande denaturering, 40 cykler av 95 °C för 5 s denaturering, 60 °C för 34 s glödgning och 72 °C för 40 s förlängning. I slutet av varje reaktion utfördes en smältkurvanalys. β-ACTIN användes som referensgen och 2-ΔΔCT-metoden tillämpades för att analysera det relativa uttrycket för varje gen (tabell 1).

Tabell 1 Primersekvenser som användes för qPCR-analys.
Western Blot (WB)-analys
Proteinexpressionen hos A375-celler med TF-behandling vid 0 μg/ml och 120 μg/ml (232,3 μM) analyserades genom WB-analys. De totala proteinerna extraherades med hjälp av en lysisbuffert (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1 % Triton, 0,1 % SDS, 5 μg/ml leupeptin och 1 mM PMSF) i 30 minuter på is med upprepad frysning och upptining. Målproteiner separerades med hjälp av denaturerande natriumdodecylsulfatpolyakrylamidgelelektrofores (SDS-PAGE) (8~12 %) och överfördes sedan till ett polyvinylidenfluorid (PVDF)-membran (Millipore, MA, USA). Membranet blockerades med 5 % fettfri mjölk i 2 timmar, följt av inkubation över natten vid 4 °C med antikroppar mot: ACTIN, ASK1, ATM, fosforylerad ATM (p-ATM), ATR, fosforylerad ATR (p-ATR), klyvt caspas 3 (c-CASP3), klyvt caspas 8 (c-CASP8), CHK1, CHK2, fosforylerad CHK1 och CHK2 (p-CHK1 och p-CHK2), JNK, fosforylerat JNK (p-JNK), C-JUN, fosforylerat C-JUN (p-C-JUN), klyvt PARP (poly ADP-ribosepolymeras), P53 och fosforylerat P53 (p-P53). Efter inkubation med den sekundära antikroppen visualiserades dessa proteiner med ett förstärkt kemiluminiscenskit (Amersham Pharmacia Biotech, Little Chalfort, UK) och detekterades med hjälp av en kemiluminiscensanalysator.
Statistisk analys
Data uttrycktes som medelvärden ± SD och utsattes för envägs ANOVA, följt av Fishers jämförelse med minsta signifikanta skillnad (LSD). Alla analyser utfördes med en uppdaterad version av DPS-programvaran (Tang och Zhang, 2013).
Resultat
Antiproliferativ effekt av TF
Som framgår av figur 1A, TF vid 50 μg/ml (96.8 μM) inhiberade signifikant livsdugligheten hos A375-celler, och de hämmande hastigheterna ökade med ökande TF-koncentrationer från 50 till 400 μg/ml (96,8 till 744,4 μM) (varje P < 0,01 jämfört med normal nivå), vilket indikerar ett koncentrationsberoende sätt. De hämmande hastigheterna ökade också med TF-behandling från 24 till 72 timmar, med IC50 på 218,9 till 84,9 μg/ml (423,8 till 164,4 μM), respektive. Därefter tillämpade vi 120, 240 och 360 μg/ml (232,3, 464,7 och 697,0 μM) som doser av TF-L, TF-M respektive TF-H. Som framgår av figur 1B hämmade TF-M uppenbarligen livskraften hos A375- och A875-celler men utövade liten effekt på HFF-1-celler. Som framgår av figur 1C förändrades A375-cellernas morfologi uppenbart och antalet levande celler minskade med TF-behandling vid ökande koncentrationer.

Figur 1 Cellviabilitet hos A375-celler med TF-behandling vid 24, 48 och 72 timmar (A), cellviabilitet hos HFF-1-, A375- och A875-celler med TF-behandling vid 24 timmar (B) och morfologi hos A375-celler med behandling med teaflavin (TF) vid 24 timmar (C). Data var medelvärde ± SD (n = 5). Med hjälp av Fisher’s LSD (least significant difference) multipla jämförelser indikerar data (medelvärde ± SD) med samma lilla bokstav (b vs bc; bc vs cd; c vs c; cd vs d; d vs d) ingen signifikant skillnad mellan varandra, medan data med olika bokstäver (a vs b vs b vs c vs b vs b vs b vs e vs f vs g) indikerar signifikant skillnad mellan varandra. Skalstreck = 200 μm.
Pro-apoptotisk effekt av TF
DAPI-färgning och flödescytometri utfördes för att utvärdera TF:s pro-apoptotiska effekt på A375-celler. Resultatet av DAPI-färgning visade apoptotisk morfologi, inklusive krympt form, karyopyknos och kärnfragmentering, i A375-celler med TF-behandling från 120 till 360 μg/ml (232,3 till 697,0 μM) (figur 2A). Antalet apoptotiska celler ökade signifikant med TF-behandling vid 240 och 360 μg/ml (464,7 och 697,0 μM) (varje P < 0,01 jämfört med NC) (Figur 2C). Resultatet av flödescytometri visade TB-inducerad tidig apoptos och sen apoptos av A375-celler (Figur 2B). Antalet tidiga och sena apoptotiska celler ökade med TF-behandling från 120 till 360 μg/ml (232,3 till 697,0 μM) (figur 2B), och deras andelar var signifikant högre med TF-behandling vid 360 μg/ml (697,0 μM) (P < 0,01 och P < 0,05 jämfört med normal nivå) (figurerna 2D, E). Resultaten indikerade att TF inducerade apoptos av A375-celler på ett koncentrationsberoende sätt.
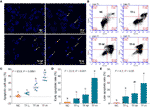
Figur 2 DAPI-färgningsobservation (A) och flödescytometrianalys (B) på A375-celler med behandling med theaflavin (TF). Statistisk analys av antalet apoptotiska celler (C), statistisk analys av antalet tidiga apoptotiska celler (D) och statistisk analys av antalet sena apoptotiska celler (E). Med hjälp av Fisher’s LSD (least significant difference) multipla jämförelser indikerar data (medelvärde ± SD) med samma bokstav med liten bokstav (a vs. ab; ab vs. b; b vs. b; c vs. c) ingen signifikant skillnad mellan varandra, medan data med olika bokstäver (a vs. b vs. c) indikerar signifikant skillnad mellan varandra. Skalstreck = 100 μm.
In Vivo Effect of TF on Xenograft Zebrafishes
Kurvorna för dödlighet och biverkningar hos zebrafishes med TF-behandling visas i fig. 3A. Fiskdöd orsakades av TF vid 31,25 μg/ml (60,5 μM), och ingen fisk överlevde med TF vid 125 μg/ml (242,0 μM), vilket indikerar att den maximala icke-dödliga dosen av TF är mindre än 31,25 μg/ml (60,5 μM). De negativa händelserna, inklusive onormal kroppsrullning och ödem, observerades vid behandling med TF från 3,47 μg/ml (6,7 μM) till högre doser, vilket indikerar att NOAEL för TF är lägre än 3,47 μg/ml (6,7 μM). Efter upprepade tester uppskattades NOAEL slutligen till 2,0 μg/ml (3,9 μM). Därmed användes 0,22, 0,67 och 2,0 μg/ml (0,4, 1,3 och 3,9 μM) som de låga, mellersta och höga doserna av TF för det efterföljande experimentet.
Som framgår av figur 3B etablerades en xenograftmodell av A375-celler i larviga zebrafiskar och de fluorescerande intensiteterna av cellmassan i fiskarna testades. Efter 24 timmars behandling hämmade TF från 0,22 till 2,0 μg/ml (0,4, 1,3 och 3,9 μM) uppenbarligen A375-tumörtillväxten, med inhiberingsgrader från 1,0 till 46,4 %. De hämmande effekterna av TF vid 0,67 och 2,0 μg/ml (1,3 och 3,9 μM) var signifikanta, om man jämförde med modellgruppen (P < 0,01), och effekten av TF vid 2,0 μg/ml (3,9 μM) var till och med högre än effekten av cisplatin vid dess NOAEL (50 μM).
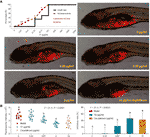
Figur 3 Dödlighet och biverkningar hos larviga zebrafiskar inducerade av teaflavin (TF) och observation av larviga zebrafiskar xenotransplanterade med A375-celler med behandling av TF eller cisplatin (A) samt fluorescensintensitet och hämmande hastigheter för TF (B). Fluorescerande område i rött representerar A375-cellmassan. Med hjälp av LSD multipla jämförelser indikerar data (medelvärde ± SD) med samma lilla bokstav (a vs. a; c vs. c) ingen signifikant skillnad mellan varandra, medan data med olika bokstäver (a vs. b vs. c) indikerar signifikant skillnad med varandra.
Molekylär verkan av TF på mRNA-uttryck i A375-celler
Det relativa mRNA-uttrycket av TF-målinriktade gener testades med qPCR-analys. Som framgår av figur 4 uppreglerades uttrycken av BAX, BIM, C-MYC, P21, P53 och PUMA signifikant av TF (varje P < 0,01 jämfört med NC-nivån), med undantag för uttrycket av BAX med TF-behandling i låg koncentration. Även om uttrycket av BCL-2 uppreglerades av TF, var förhållandet BAX/BCL-2 signifikant högre med TF-behandling vid dess medelhöga till höga koncentrationer än vid NC-nivå (P < 0,01), vilket indikerar BAX:s huvudroll i TF:s verkan.
Molekylär verkan av TB på proteinexpressioner i A375-celler
WB tillämpades för att bestämma uttrycket och fosforyleringen av proteiner som är måltavlor för TF. Som framgår av figur 5 var uttrycken av ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8 och c-CASP3 signifikant uppreglerade av TF vid 120 μg/ml (232,3 μM) (varje P < 0,01 jämfört med NC-nivå). Dessutom var TF:s åtgärder på ATR, p-ATR, CHK2, P53, C-JUN (43 kd) och p-C-JUN (Ser 73) obetydliga (vardera P > 0,05 jämfört med NC-nivå).
Diskussion
Trots att TF:s anti-canceraktiviteter har dokumenterats väl (Sur och Panda, 2017; Takemoto och Takemoto, 2018; Sajadimajd et al, 2020), är kunskapen om dess effektivitet på melanom fortfarande liten. För att fylla denna lucka genomfördes i denna studie in vitro- och in vivo-experiment för att studera TF:s effekter och mekanism mot melanomceller. För första gången visade vi de cytotoxiska proapoptotiska och tumörhämmande effekterna av TF på melanom A375-celler. Dess mekanism föreslogs vara förknippad med P53- och JNK-vägar. Nyheten i denna studie är upptäckten av TF′s effektivitet mot melanom, medan tidigare rapporter endast fokuserade på TF′s effekter på andra tumörer (Lin, 2002; Sur och Panda, 2017). Vidare är detta också den första rapporten om TF:s molekylära verkan på JNK-vägen, medan den P53-vägsassocierade mekanismen för TF′s proapoptotiska effekt på cancerceller tidigare har rapporterats (Lahiry et al., 2008).
På senare tid har xenograft-tumörmodeller med hjälp av larviga zebrafiskar rönt allt större uppmärksamhet för studier av cancerbekämpning, på grund av fördelarna med larviga zebrafiskar jämfört med andra djurmodeller: (1) avsaknaden av immunavstötning mot mänskliga celler ger högre framgång för xenotransplantation, (2) kroppens transparens ger in vivo synliga observationer av tumörtillväxt och läkemedelstoxicitet, och (3) storskalig generering och snabb organogenes ger kortare experimentella perioder (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). I den här studien utövade TF en dosberoende hämmande effekt på A375-tumörmassan hos larviga zebrafiskar (figur 3B), med en hämmande effekt på 46,4 % vid dess NOAEL (3,9 μM). Hämningsgraden var högre än för cisplatin, vilket tyder på att TF var effektivare än cisplatin inom deras respektive säkra dosintervall. Dessutom var inhibitionsgraden högre än den för ett annat tepigment (theabrownin) (Jin et al., 2018), vilket tyder på att TF är den mest effektiva komponenten i te. Det effektiva dosområdet in vivo (1,3 till 3,9 μM) för TF är dock mycket lägre än dess effektiva dosområde in vitro (96,8 till 774,4 μM). Orsaken till denna skillnad kan vara att de metaboliserade TF-derivaten efter oral administrering har högre effekt än TF. Det tyder på att oral applicering kan vara effektivare än andra vägar för TF.
Enligt dosomvandlingsregeln kan de effektiva doserna (1,3 och 3,9 μM) av TF i larviga zebrafiskar uppskattas till 0,03 till 0,09 mg/kg hos människa (Zhang et al., 2003). Det tyder på att oral administrering av TF vid ett så lågt dosintervall kan vara effektiv vid behandling av patienter med melanom, vilket indikerar en god kostnadseffektivitet för denna förening. Såvitt vi vet finns det endast ett fåtal rapporter om den kliniska tillämpningen av TF. I en dubbelblind, randomiserad, placebokontrollerad studie med parallella grupper har man tillämpat TF-berikat grönt teextrakt för att behandla patienter med mild till måttlig hyperkolesterolemi i 12 veckor (Maron et al., 2003). I den studien var det dagliga intaget av TF 75 mg i grönt teextrakt, vilket signifikant minskade totalkolesterol, LDL-C och triglycerider hos hyperkolesterolemiska vuxna utan observation av betydande biverkningar (Maron et al., 2003). I den här studien var det effektiva dosintervallet av TF mycket lägre än det rapporterade, vilket tyder på en större potential för TF för melanombehandling i kliniken. Men även om det effektiva dosintervallet för TF var litet, var dess dödliga doströskel för zebrafisklarver också låg (<60,5 μM) och var lägre än andra tepigment (figur 3A) (Jin et al., 2018), vilket lämnar en oro för TF:s potentiella toxicitet för människor. Intressant nog fann vi att TF utövade liten effekt på den normala cellinjen (HFF-1 hudfibroblast) (Figur 1B), vilket tyder på en klinisk genomförbarhet för dess externa användning som kan undvika den potentiella toxiciteten av dess interna användning.
Vårt mekanistiskt experiment visade att TF aktiverade ATM, CHK1/2, P53, CASP8/3 i P53-vägen och även aktiverade ASK1, JNK och C-JUN i JNK-vägen, vilket associerade med A375-cellens apoptos. Apoptosen fastställdes genom DAPI-färgning och flödescytometrisk analys på cellulär nivå (figur 2) och förmedlades genom överuttryck av proapoptotiska gener (P53, BAX, BIM och PUMA) och aktivering av apoptosrelaterade proteiner (caspaser och PARP) på molekylär nivå (figurerna 4 och 5). P53 (TP53) kodar för ett DNA-bindande nukleärt foskoprotein med tumörsuppressoraktivitet, som fungerar som transkriptionsfaktor i centrum av ett nätverk för kontroll av apoptos som svar på cellulära påfrestningar (Martin et al., 2002). Den aktiverar apoptos genom att stimulera transkriptionen av gener ur Bcl-2-familjen, såsom BAX, BIM och PUMA (Levine och Oren, 2009). BAX och BIM kodar för proapoptotiska medlemmar som framkallar apoptos och celldöd genom att aktivera caspas-kaskaden som svar på apoptotiska stimuli (Rossé et al., 1998; Youle och Strasser, 2008). PUMA, som en P53-uppreglerad modulator av apoptos, kodar för ett BH3-domäninnehållande protein som lokaliseras till mitokondrierna, interagerar med Bax och Bak och aktiverar caspasskaskaden genom klyvning av CASP3 (Nakano och Vousden, 2001; Letai, 2009). I den här studien klyvdes CASP8 och CASP3 som svar på P53-aktivering. CASP8 är ett initierande caspas i den apoptotiska kaskaden, som aktiverar CASP3 för apoptotisk DNA-fragmentering, vilket resulterar i efterföljande klyvning av PARP (c-PARP) för att utföra den apoptotiska processen (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP ansvarar för DNA-reparation och cellens livskraft som svar på exogen stress (Satoh och Lindahl, 1992). Det kan klyvas av CASP3 och underlättar därmed den cellulära nedmonteringen vid apoptos (Oliver et al., 1998). Således kan mängden klyvt PARP (c-PARP) användas som markör för cellapoptos.
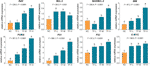
Figur 4 Relativt mRNA-uttryck av deaflavin (TF)-riktade generna i A375-celler efter 24 timmars behandling. Med hjälp av Fisher’s LSD (least significant difference) multipla jämförelser indikerar data (medelvärde ± SD) med samma små bokstav (a vs. a; b vs. b; c vs. c) ingen signifikant skillnad mellan varandra, medan data med olika bokstäver (a vs.
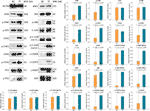
Figur 5 Uttryck och fosforylering av proteiner som är målinriktade motaflavin (TF) i A375-celler efter 24 timmars behandling. Data (medelvärde ± SD) med olika små bokstäver är signifikant olika med varandra vid Fisher’s minst signifikanta skillnad (LSD) multipla jämförelser.
I våra tidigare studier har vi rapporterat att induktion av DNA-skador var förknippad med P53-sökvägsmedierad pro-apoptotisk mekanism av theabrownin (Wu et al., 2016; Jin et al., 2018). Men även om både TF och theabrownin aktiverade P53-vägen och inducerade tumörcellsapoptos, fann vi inte DNA-skadeinduktion med TF-behandling i den här studien. Alternativt fann vi aktivering av ASK1-JNK-C-JUN-kaskaden, som också fungerar som apoptotisk väg. I denna signalmodul är ASK1 (apoptosis signal-regulating kinase 1) ett mitogenaktiverat proteinkinas som spelar en nyckelroll i cytokin- och stressinducerad apoptos genom att utlösa mitokondrieberoende väg (Matsuzawa och Ichijo, 2001; Zhang et al., 2003). Det aktiverar nedströms JNK-signalering som svar på olika typer av stress, vilket leder till cellapoptos genom C-JUN-aktivering och efterföljande överexpression av proapoptotiska gener (Tobiume et al., 2001). Kemoterapeutika, såsom cisplatin, docetaxel och paclitaxel, har rapporterats inducera apoptos av melanomceller genom JNK-vägen oberoende av P53-vägen (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). Detta tyder på att TF kan ha en fördel jämfört med dessa läkemedel på grund av dess dubbelvägsmedierade verkningsmekanism, vilket preliminärt har visats genom de högre tumörhämmande effekterna av TF än av cisplatin i denna studie. Det finns dock vissa begränsningar i denna studie enligt följande: (1) P53- och JNK-vägarnas verkan i den föreslagna dubbelvägsmedierade mekanismen för TF har inte verifierats, (2) interaktionen mellan P53- och JNK-vägarna har inte undersökts, och vilken väg som spelar huvudrollen är okänd, och (3) in vitro-doseringsintervallet och in vivo-doseringsintervallet skiljer sig ganska mycket åt, vilket har förklarats, men det behövs experimentella bevis. För att ta itu med dessa frågor behövs ytterligare studier i framtiden. Till exempel bör siRNAs eller hämmare av P53 och JNK användas för att verifiera verkan av dessa vägar och för att utforska interaktionen mellan varandra, och serummetaboliterna av TF bör analyseras kemiskt och studeras farmakologiskt för att testa vår hypotes om att de metaboliserade TF-derivaten har högre effekt än den av TF. Eftersom det dessutom inte finns några kliniska rapporter om TF för cancerbehandling bör den terapeutiska effekten och fördelarna med TF på cancerpatienter studeras ytterligare.
Slutsats
Då TF:s anti-cancerpotential har dokumenterats väl, förblir det osäkert om TF är effektivt vid behandling av melanom. I den här studien, genom att använda melanomcellinje och xenograft zebrafiskmodell, fann vi cytotoxiska pro-apoptotiska och tumörhämmande effekter av TF på melanomceller och avslöjade dess mekanism i samband med aktiveringar av P53 och JNK-vägar. Detta är den första studien som beskriver TF:s effekter och mekanism mot melanomceller. Eftersom TF:s mekanism inte bara var beroende av P53-vägen kan man förvänta sig att TF kan vara effektiv vid behandling av P53-muterade cellinjer. Ytterligare studier är motiverade för att verifiera denna härledning. Sammantaget ger denna studie bevis för TF:s effektivitet mot melanom, vilket bidrar till utvecklingen av TF-deriverade medel för melanombehandling.
Data Availability Statement
Rådata som stödjer slutsatserna i denna artikel är tillgängliga från motsvarande författare på rimlig begäran.
Etikutlåtande
Djurstudien granskades och godkändes av etikkommittén vid Zhejiang Chinese Medical University.
Författarbidrag
LeZ utförde det huvudsakliga arbetet med denna artikel. BY utförde de cellulära och molekylära experimenten. LiZ och SM bidrog till skrivandet av detta manuskript. WD bidrog med idéer och finansiellt stöd till detta arbete. YX genomförde experimentet med zebrafiskar. LS utformade detta arbete och utarbetade manuskriptet. TE förbättrade utformningen och utkastet till detta arbete. Alla författare bidrog till artikeln och godkände den inlämnade versionen.
Finansiering
Detta arbete stöddes av Kinas nationella naturvetenskapliga stiftelse (Grant No. 81774331, 81873049 och 81973873), Kinas provinsiella naturvetenskapliga stiftelse i Zhejiang (Grant No. LY18H270004), Kinas provinsiella vetenskaps- och teknikprojekt för traditionell kinesisk medicin i Zhejiang (Grant No. 2016ZZ011), Zhejiang Provincial Key Construction University Superiority Characteristic Discipline (Traditional Chinese Pharmacology) och Opening Foundation of China (Grant No. ZYX2018006).
Intressekonflikt
YX var anställd av företaget Hunter Biotechnology, Inc.
Restande författare förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Abkortningar
DAPI, 4′-6-diamidino-2-phenylindol; DMEM, Dulbecco′s modified Eagle′s medium; DMSO, dimetylsulfoxid; dpf, dagar efter befruktning; FBS, fetalt bovint serum; FI, fluorescensintensitet; LSD, Fishers minsta signifikanta skillnad; NOAEL, no observed adverse effect level; MTT, 3-(4,5-dimetylthiazol-2-yl)-2,5-difenyltetrazoliumbromid; PARP, poly ADP-ribosepolymeras; SDS-PAGE, denaturerande natriumdodecylsulfat-polyakrylamidgelelektrofores; TCM, teaflavin; TF, traditionell kinesisk medicin.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Theaflaviner fördröjer mänsklig bröstcancercells migration genom att hämma NF-kappaB via p53-ROS cross-talk. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. (1999). Rollen för poly(ADP-ribose)polymeras (PARP) klyvning i apoptos. Caspase 3-resistent PARP-mutant ökar apoptosfrekvensen i transfekterade celler. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). Caspase-3 krävs för DNA-fragmentering och morfologiska förändringar i samband med apoptos. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownin utlöser DNA-skador för att undertrycka humant osteosarkom U2OS-celler genom att aktivera p53-signalvägen. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebrafisk xenografts som ett verktyg för in vivo-studier av cancer hos människor. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Jämförande studier av de hypolipidemiska och tillväxthämmande effekterna av oolong-, svart-, pu-erh- och grönt te hos råttor. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Bidrag från p53-medierad Bax-transaktivering vid theaflavininducerad apoptos av bröstepitelkarcinomceller. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Theaflaviner riktar in sig på Fas/caspase-8 och Akt/pBad för att inducera apoptos i p53-muterade humana bröstcancerceller. Carcinogenesis 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Zebrafisk: en ny modell på den farmaceutiska catwalken. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Kutant melanom: From pathogenesis to therapy (Review). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma strikes Bax. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.20090313134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). De första 30 åren med p53: växer sig allt mer komplexa. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Theaflaviner hämmar ATP-syntesen och den respiratoriska kedjan utan att öka superoxidproduktionen. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Kemoprevention av cancer med tepolyfenoler genom modulering av signaltransduktionsvägar. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Vitexinförening 1, ett nytt extrakt från en kinesisk ört, undertrycker melanomcellstillväxt genom DNA-skador genom att öka ROS-nivåerna. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatin inducerar den proapoptotiska konformationen av Bak på ett deltaMEKK1-beroende sätt. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Te och dess komponenter förebygger cancer: En genomgång av den redoxrelaterade mekanismen. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Kolesterolsänkande effekt av ett teaflavinberikat grönt teextrakt: en randomiserad kontrollerad studie. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Integrering av mutationsdata och strukturell analys av tumörundertryckarproteinet TP53. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Molekylära mekanismer för beslutet mellan liv och död: reglering av apoptos av apoptos signalreglerande kinas 1. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Involvering av endoplasmatisk retikulumstress i Docetaxel-inducerad JNK-beroende apoptos av humant melanom. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumin: En ny kandidat för behandling av melanom? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, en ny proapoptotisk gen, induceras av p53. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Framväxande nanotekniska strategier för systemisk kemoterapi mot melanom. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Betydelsen av poly(ADP-ribose)polymeras och dess klyvning i apoptos. Lärdom från en mutant som inte kan spaltas. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). Screening av ryggradsdjur in vivo med hög kapacitet. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). Fenoliska ämnen i tillverkat te. I. Fraktionering och papperskromatografi av vattenlösliga ämnen. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Framsteg inom immunterapi för melanom: En omfattande genomgång. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Framsteg om naturliga polyfenoler som cancerbekämpningsmedel för hudcancer. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Poly(ADP-ribose)-bildningens roll vid DNA-reparation. Nature 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Taxol-inducerad mitokondriell stress i melanomceller förmedlas genom aktivering av c-Jun N-terminal kinase (JNK) och p38-vägar via frikopplingsprotein 2. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Theaflaviner undertrycker tumörtillväxt och metastasering via blockering av STAT3-vägen i hepatocellulärt karcinom. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). Pro-caspase-3 är ett viktigt fysiologiskt mål för caspase-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Molekylära aspekter av cancerkemopreventiva och terapeutiska effekter av te och tepolyfenoler. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Syntes av teaflaviner och deras funktioner. Mol. (Basel Switzerland) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). DPS-programvara (Data Processing System) med experimentell utformning, statistisk analys och datautvinning utvecklad för användning inom entomologisk forskning. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 är nödvändig för att upprätthålla aktivering av JNK/p38 MAP-kinaser och apoptos. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analyser av teorin om cancertoxins patogeneseteori och teorin om ”konsolidering av kroppens motståndskraft och rensning av källan”. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Antiproliferativ och apoptosinducerande effekt av theabrownin mot icke-småcellig lung adenokarcinom A549-celler. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). En epidemiologisk genomgång av kost och kutant malignt melanom. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). BCL-2-proteinfamiljen: motsatta aktiviteter som förmedlar celldöd. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Zebrafisk: en djurmodell för toxikologiska studier. Curr. Protoc. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Theabrownin hämmar cellcykelprogression och tumörtillväxt av lungkarcinom genom c-myc-relaterad mekanism. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar