- Introduktion
- Material och metoder
- Studiepopulation
- Studievariabler
- Resultat
- Fördelning av AB0/Rh-blodgrupp hos patienter med PCa
- Ingen signifikanta skillnader i klinisk-patologiska egenskaper bland PCa-patienter enligt AB0/Rh-blodgrupper
- Inget signifikant prognostiskt värde av blodgrupp för BCR-fri överlevnad efter RP
- Diskussion
- Informerat samtycke
- Etiskt uttalande
- Författarbidrag
- Intressekonfliktförklaring
Introduktion
Prostatacancer (PCa) är den vanligaste maligniteten i västvärlden och den näst vanligaste orsaken till cancerrelaterade dödsfall hos män (1). De mest kända riskfaktorerna för att utveckla PCa är stigande ålder, etniskt ursprung och familjehistoria (2). Den familjära predispositionen tyder på en ärftlig genetisk komponent i sjukdomen (3), men står endast för en minoritet (5-10 %) av PCa fallen. Följaktligen är predisponerande miljö- och genetiska faktorer för de flesta patienter fortfarande okända (4, 5). Blodgrupp AB0 är en ärftlig egenskap som har förknippats med både förekomst och prognos av flera maligniteter (6-8). Flera plausibla mekanismer, inklusive inflammation, immunövervakning av maligna celler, intercellulär vidhäftning och membransignalering har föreslagits för att förklara det observerade sambandet mellan AB0-blodgrupper och cancerrisk.
AB0-blodgruppsantigen (ABH) är glykoproteiner som uttrycks på ytan av röda blodkroppar. De fenotypiska A- och B-antigenerna är terminala kolhydrater som syntetiseras genom addition av enskilda sockerarter som katalyseras av en rad specifika glykosyltransferaser. Fenotyp 0 kännetecknas av avsaknad av A- och B-glykosyltransferaser, så att endast en proteinryggrad, H-antigenet, är närvarande. Antigener från röda blodkroppar har olika funktioner, inklusive membranstrukturell integritet, transport av molekyler genom membran och adhesion (9). Förutom att de uttrycks på röda blodkroppar uttrycks ABH-antigenerna också i en rad olika epitelceller, bland annat i urothelium, gastrointestinala slemhinnor och lungor. Flera studier har visat att ABH-uttrycksmönstret i cancercellerna förändras beroende på tumörgrad och sjukdomsprogression, vilket tyder på ett möjligt samband mellan AB0-blodgrupp och risken för vissa epiteliala maligniteter (8, 10). Nyligen genomförda studier visade att personer med blodgrupp A, AB eller B hade en ökad incidens av bukspottkörtelcancer jämfört med personer med blodgrupp 0, medan den högsta risken bland dem visade sig vara relaterad till blodgrupp B (8). På samma sätt rapporterades blodserotyp A vara förknippad med högre risk för magsäcks-, bröst- och äggstockscancer (11). Å andra sidan var blodgrupp 0 korrelerad med de högsta recidiv- och progressionsfrekvenserna efter transuretral resektion av urinblåsan och därmed förknippad med en sämre prognos hos patienter med icke-muskelinvasivt urinblåseurotelkarcinom (6).
Baserat på de nuvarande bevisen för blodgruppens prediktiva roll vid flera maligniteter, antog vi att blodgruppstypen kan användas som en ytterligare parameter som underlättar riskbedömningen och hjälper till att uppskatta prognosen efter operation hos patienter med PCa. I den aktuella litteraturen finns endast begränsad klinisk evidens tillgänglig när det gäller blodgrupp och PCa i allmänhet, vilket visade på kontroversiella resultat (12-14) Dessutom finns det för närvarande endast en studie med särskilt fokus på blodgruppens inverkan på utfallet hos patienter efter radikal prostatektomi (RP) (13). Med hjälp av 555 patienter med PCa som genomgått RP visade författarna att AB0-blodgrupp var en oberoende prediktor för biokemiskt återfall (BCR) i den multivariabla analysen men inte i den univariabla analysen.
Syftet med denna studie var därför att tillföra ytterligare information till den pågående debatten genom att analysera korrelationen mellan AB0/Rh blodgrupp och dess fördelning inom patienter med PCa, tumörpatologi, recidiv och mortalitet hos patienter med lokaliserad PCa som genomgår RP med hjälp av ett stort datamaterial från ett enda center med 3 574 patienter.
Material och metoder
Studiepopulation
Studien godkändes av den institutionella granskningsnämnden. Totalt 3 582 patienter med kliniskt lokaliserad PCa som genomgick RP vid vår institution mellan 2009 och 2010 screenades för inkludering i studien. De som hade ofullständiga dataset och saknade uppföljning exkluderades (n = 8), vilket lämnade 3 574 patienter tillgängliga för analys.
Radikal prostatektomi utfördes med hjälp av ett öppet retropubiskt tillvägagångssätt (n = 3 220) eller robotassisterat laparoskopiskt tillvägagångssätt (n = 354), enligt tidigare beskrivning (15). Lymfkörteldissektion utfördes hos D’Amicos patienter med intermediär risk och hög risk i enlighet med riktlinjerna från European Association of Urology (EAU) för PCa (16). Kirurgiska prover behandlades enligt histopatologiska standardförfaranden och utvärderades av erfarna uropatologer i ett centrum med hög volym (>2 000 prostatektomiprover per år). Tumörer stadieindelades enligt 2007 års TNM-stadiesystem från American Joint Committee on Cancer och histopatologisk gradering tilldelades enligt Gleason-systemet (17).
Alla deltagare genomgick serologisk testning före RP. Laboratoriebekräftelse av AB0 och Rh-blodgrupp erhölls från avdelningen för transfusionsmedicin, Universitetssjukhuset Hamburg-Eppendorf. AB0-referensfördelningen i den tyska befolkningen användes som kontroll (18).
Studievariabler
Studievariablerna omfattade AB0/Rh-blodgrupp, ålder, preoperativt prostataspecifikt antigen (PSA), prostatavolym (transrektalt ultraljud), Gleason-poäng (provexemplar), pT-stadie, pN-stadie, kirurgisk marginal, BCR och mortalitet efter RP. Patientuppföljningen bestod av PSA-test var 3-6 månad under de första 2 åren efter RP, BCR definierades som PSA-nivå ≥0,2 ng/ml.
Sambandet mellan AB0-blodgrupp och klinikopatologiska variabler bedömdes med hjälp av chi-kvadrat-test och t-test. I Cox-regression multivariabel analys (log-rank-test) bedömdes effekten av blodgrupp, preoperativt PSA, Gleason-poäng, pT-stadium, pN-status och kirurgisk marginal på BCR-fri överlevnad för att utvärdera de prognostiska värdena för överlevnad. Sannolikheten för BCR-fri överlevnad jämfördes i 0-, A-, B- och AB-grupperna med hjälp av Kaplan-Meier-analys och log-rank-testet.
Alla tester var tvåsidiga och p-värden <0,05 ansågs vara statistiskt signifikanta. Statistiska analyser utfördes med JMP-programvaran v9.0.2 (SAS Institute, Inc, Cary, NC, USA) och R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Resultat
Totalt 3 574 patienter med kliniskt lokaliserad PCa var berättigade till slutliga analyser, medianåldern vid operationen var 65 år (intervall: 38-80) och medianuppföljningen var 36,9 månader (tabell 1).

Tabell 1. Samband mellan AB0-blodgrupp och Rhesusfaktor och klinisk-patologiska egenskaper hos 3 574 patienter som behandlades med radikal prostatektomi.
Fördelning av AB0/Rh-blodgrupp hos patienter med PCa
Fördelningen av AB0-blodgrupp bland patienter med PCa före RP var som följer: Fördelningen av blodgruppsgrupperna före blodgruppsbyte hos patienterna med PCA före blodgruppsbyte var följande: 0 hos 1350 (38 %), A hos 1660 (45 %), B hos 445 (12 %) och AB hos 174 (5 %) patienter. 83 % av patienterna var Rh-positiva (tabell 1). Referensfördelningen för den tyska befolkningen är följande (18): 0 i 41 %, A i 43 %, B i 11 %, AB i 5 %, Rhesuspositiv: 85 %. De övergripande fördelningarna av AB0- samt Rh-blodgrupper i studiekohorten motsvarade den fördelning som observerades i den tyska manliga befolkningen.
Ingen signifikanta skillnader i klinisk-patologiska egenskaper bland PCa-patienter enligt AB0/Rh-blodgrupper
Majoriteten av patienterna hade kliniskt lokaliserad PCa med intermediär riskprofil. Den mest rapporterade Gleason-poängen var 3 + 4 (66,9 %) och 63,3 % av patienterna hade preoperativa PSA-nivåer inom intervallet 4-10 ng/ml. pT2-tumörer upptäcktes hos 68,7 % och negativa marginaler uppnåddes hos 81,3 % av patienterna. Medianvolymen för prostatan var 40 ml och lymfkörtelpåverkan diagnostiserades hos 224 (6,3 %) patienter (tabell 1). Det fanns inga signifikanta skillnader i klinisk-patologiska egenskaper bland patienter med olika AB0-blodgrupper. Något ökade andelar med avancerat tumörstadium (≥pT3b) fanns hos patienter med blodgrupp AB jämfört med blodgrupperna 0, A och B (16,1, 12,6, 9,9 respektive 13,7 %, p = 0,033). Patientpopulationen med AB uppvisade också en måttligt ökad andel negativ Rh-faktor (21,8 %) jämfört med de andra blodgrupperna (16,9 %, p = 0,01) (tabell 1).
Inget signifikant prognostiskt värde av blodgrupp för BCR-fri överlevnad efter RP
Enligt multivariabel cox-regressionsanalys korrelerade preoperativ PSA, Gleason-poäng, pT-stadium, pN-status och kirurgisk marginal signifikant och oberoende av varandra med BCR-fri överlevnad (alla p < 0,05) (tabell 2). Vi kunde dock inte observera någon inverkan av blodgruppen AB0 på BCR-frekvensen (figur 1). Vi bedömde vidare det prognostiska värdet av blodgrupp 0 jämfört med blodgrupper som inte är 0 samt inom de alternativa blodgrupperna A/B/AB med insignifikanta resultat (tabell 2). Även om subanalyser med enbart patienter med positiv eller negativ marginalstatus utfördes förblev inflytandet av AB0/Rh på BCR obetydligt (figurerna 2A,B). Dessutom hade patienternas Rhesusfaktorstatus inte heller någon inverkan på BCR-fri överlevnad (p = 0,74).
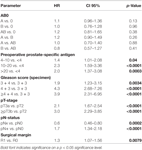
Tabell 2. Multivariabla cox-regressionsmodeller för AB0 och standardprognostiska faktorer för biokemisk recidivfri överlevnad.
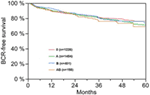
Figur 1. Biokemisk recidiv (BCR)-fri överlevnad efter radikal prostatektomi stratifierad efter AB0 blodgrupper (p = 0,572).
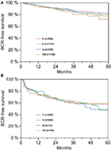
Figur 2. (A,B) Biokemisk recidiv (BCR)-fri överlevnad efter radikal prostatektomi stratifierad efter AB0-blodgrupper hos patienter med negativ och positiv kirurgisk marginalstatus.
Diskussion
Möjliga associationer mellan AB0-blodgrupp och risken för vissa epiteliala maligniteter, inklusive bukspottkörtelns, kolorektalens och magsäckscancerns cancer har rapporterats frekvent (19, 20). Dessutom är AB0/Rh-blodgrupperna tillgängliga för de flesta patienter före ett kirurgiskt ingrepp, vilket därmed föreslås som en idealisk kompletterande markör utan några ytterligare laboratorieprocesssteg.
För flera decennier sedan visade immunohistokemiska studier att PCa-celler som härstammar från patienter uppvisar andra mönster för ABH-uttryck än normala/benigna prostataceller (21). Eftersom både AB0-blodgrupp och dess antigenuttryck på vävnad har rapporterats vara förknippade med incidens, sjukdomsprogression och utfall i flera maligniteter (8, 22, 23), föreslog ett sådant förändrat uttryck av ABH-antigen i prostatavävnad en möjlig påverkan av blodgruppen på malign omvandling av prostataceller.
I en färsk studie som publicerades av Markt och kollegor (14) analyserades förhållandet mellan AB0-blodgrupp och risken för att hysa aggressivt PCa. Författarna analyserade ett dataset med 2 774 patienter med aggressiv PCa och 4 443 patienter utan PCa som kontroller. Med hjälp av dessa data kunde man inte påvisa något signifikant samband mellan AB0-blodgrupp eller ”dos” av A- eller B-alleler och risken för aggressiv PCa. Författarna rapporterade även cancerspecifik och total dödlighet stratifierad efter blodgrupper, men studien innehöll ingen information om behandling av PCa. Dessutom ingick endast patienter med aggressiva tumörer, vilket kan maskera den potentiella effekten av olika blodgrupper.
Dessa resultat är i linje med en studie som Kvist och kollegor genomförde, som inte visade något samband mellan AB0-blodgrupp och överlevnad hos patienter med PCa som hanterades med watchful waiting. Denna studie begränsades främst av det lilla antalet fall (n = 279) (12). Intressant nog rapporterade nyligen den enda studien med fokus på patienter efter RP som omfattade 555 japanska patienter att blodgrupp 0 var signifikant förknippad med en minskad risk för BCR efter RP i multivariabel men inte univariabel analys (13). I subanalysen av patienter med negativ kirurgisk marginal var den 5-års BCR-fria frekvensen i blodgrupp 0 signifikant högre än i grupp A (91,2 vs. 71,0 %; p = 0,026). I denna studiekohort hade 46,3 % av patienterna positiv marginalstatus trots ett kliniskt stadium T1c hos 74,2 % av patienterna. Det patologiska stadiet (pT) nämndes inte.
Vår retrospektiva kohort av 3 574 patienter med kliniskt lokaliserad PCa är den största kohort som hittills analyserats för att fastställa en eventuell inverkan av både AB0- och Rh-blodgrupperna på tumörkarakteristika och utfall efter RP. I den aktuella studien hade majoriteten av patienterna pT2-tumörer (68,7 %) och 18,6 % hade positiv marginalstatus. Med hjälp av dessa data kunde vi inte påvisa någon signifikant inverkan av AB0/Rh-blodgrupper på klinisk-patologiska egenskaper (preoperativt PSA, Gleason-poäng, prostatavolym, pT-stadium, pN-status och kirurgisk marginal) och BCR-fri överlevnad efter kurativ RP. När man dessutom utförde en subanalys med enbart patienter med positiv eller negativ marginalstatus förblev AB0/Rh:s inflytande på BCR obetydligt. Därför kunde vi inte reproducera resultaten från den japanska studien (13). Till skillnad från andra maligniteter som bukspottkörtel- eller blåscancer gav AB0/Rh-blodgrupp inget prognostiskt värde vid PCa.
Det finns flera viktiga begränsningar i vår studie. Först och främst är de begränsningar som är inneboende i retrospektiva analyser och avsaknaden av en kontrollgrupp. Dessutom innehåller vår studiekohort övervägande lokaliserad PCa med låg till intermediär riskprofil (Gleason score 3 + 4 i 66,9 %, preoperativt PSA på 4-10 ng/ml i 63,3 %, pT2 i 68,7 % och negativa marginaler i 81,3 % av patienterna) vilket gör det möjligt att göra ett förval av patienter med gynnsam prognos. Dessutom är den totala fördelningen av AB – i motsats till de andra blodgrupperna – generellt sett låg rikligt förekommande (4,9 %). Vissa observationer såsom den måttligt ökade andelen negativ Rh-faktor (21,8 %) hos patienter med AB i jämförelse med de andra blodgrupperna (16,9 %, p = 0,01) skulle möjligen kunna förstärkas på grund av sällsyntheten av Rh-negativ AB-typ, vilket förhindrar en statistiskt signifikant upptäckt av en korrelation inom denna undergrupp. Slutligen saknades information om genotyp för respektive blodgrupp.
Inom de ovan nämnda egenskaperna kan miljö-, geografiska och rasrelaterade aspekter aldrig försummas när man diskuterar korrelationer mellan AB0-blodgrupp och cancer. De rasliga och etniska skillnaderna i blodgrupper såväl som i PCa är välkända (24, 25). I Europa, där PCa är den vanligaste maligniteten och den näst vanligaste orsaken till cancerrelaterad död hos män (1), är de vanligaste blodgrupperna A och 0, som ökar till allel B från väst till öst. Asiatiska länder med lägst incidens och låg grad av PCa kännetecknas däremot av en hög förekomst av typ B och relativt låg frekvens av 0, samt en mindre befolkning med negativ Rh-faktor (26). I detta avseende skiljer sig våra resultat från den aktuella studien hos japanska patienter med relativt hög positiv marginalstatus och BCR efter kurativ RP (13).
Flera mekanismer har föreslagits för att förklara hur blodgrupp påverkar cancerincidens och cancerprogression; de är dock fortfarande oklara. När det gäller blåscancer föreslogs en kromosomal aberration, eftersom AB0-genen ligger på kromosom 9q34, ett område som ofta förändras vid blåscancer (27). Eftersom AB0-genen faktiskt kodar för glykosyltransferaser, som katalyserar överföringen av sockerarter till H-antigenet (0), är förekomsten av blåscancer potentiellt korrelerad med blodgrupp 0. I motsats till detta har det rapporterats att personer med blodgrupper som inte är 0 (A, AB och B) har en förhöjd risk att utveckla magsäckscancer, vilket tyder på att blodgruppen har en cancerspecifik roll.
När det gäller PCa pågår flera insatser för att belysa blodgruppens roll för överlevnad efter behandling. Det har redan rapporterats att patienter med blodgrupp icke-0 borde ha en ökad risk för venös tromboembolism efter RP, vilket skulle kunna påverka resultatet (28). Även en nyligen publicerad studie visade att serumantikroppar mot blodgrupp A förutsäger överlevnad efter PROSTVAC-VF (ett poxvirusbaserat terapeutiskt cancervaccin som befinner sig i kliniska fas III-studier för behandling av avancerad PCa) och bör betraktas som en ny potentiellt prediktiv biomarkör för PROSTVAC-VF (29). Även om vi inte observerade något tydligt samband mellan AB0/Rh-blodgrupp och tumörpatologi och resultat i vår studie, tyder sådana bevis ändå på en prediktiv roll för blodgruppen i PCa epidemiologi och kliniskt resultat, särskilt med tanke på terapisvar.
Denna studie med 3 574 patienter är den största hittills som analyserar effekten av AB0- eller Rh-blodgrupper på patologi och utfall efter RP och tillför viktig kunskap till litteraturen.
Slutsatsen är att våra data tyder på att det inte finns någon relevant koppling mellan AB0/Rhesus-blodgrupp och ogynnsamma klinisk-patologiska tumörkarakteristika eller onkologiskt utfall efter kirurgi i motsats till flera andra maligniteter. Icke desto mindre är ytterligare forskning indicerad för att bedöma ett eventuellt samband mellan blodgruppens genotyp eller dess antigenuttryck på PCa-vävnad och prognos inom olika terapigrupper, inklusive höggradig eller avancerad PCa, som inte var tillräckligt reflekterade i vår undersökningsgrupp.
Informerat samtycke
Informerat samtycke inhämtades från alla individuella deltagare som ingick i studien.
Etiskt uttalande
Alla förfaranden som utfördes i studier med mänskliga deltagare var i enlighet med den institutionella och/eller nationella forskningskommitténs etiska standarder och med Helsingforsdeklarationen från 1964 och dess senare ändringar eller jämförbara etiska standarder.
Författarbidrag
SO, DT och TS: väsentliga bidrag till arbetets utformning eller design, utarbetande av arbetet, slutligt godkännande av den version som ska publiceras. PM: betydande bidrag till utformning eller design av arbetet, utarbetande av arbetet, slutligt godkännande av den version som ska publiceras. FC: insamling, analys eller tolkning av data för arbetet, kritisk granskning av arbetet med avseende på viktigt intellektuellt innehåll, slutligt godkännande av den version som ska publiceras. PT: insamling, analys eller tolkning av data för arbetet, kritisk granskning för viktigt intellektuellt innehåll, slutligt godkännande av den version som ska publiceras. SP: insamling, analys eller tolkning av data för arbetet, kritisk granskning för viktigt intellektuellt innehåll, slutligt godkännande av den version som ska publiceras. JLH, JH och MG: förvärv, analys eller tolkning av data för arbetet, kritisk granskning för viktigt intellektuellt innehåll, slutligt godkännande av den version som ska publiceras. Alla författare gick med på att ansvara för alla aspekter av arbetet genom att se till att frågor som rör noggrannheten eller integriteten hos någon del av arbetet undersöks och löses på lämpligt sätt.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Den handläggande redaktören förklarade att han/hon hade en delad anknytning, men inget annat samarbete, med flera av författarna (FC, SP, JH och DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Cancerstatistik, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Riskfaktorer för prostatacancer. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Genetisk etiologi för ärftlig prostatacancer. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Rapporterad familjehistoria av cancer i screeningstudien om screening av prostatacancer, lungcancer, kolorektalcancer och äggstockscancer. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. ABO-blodtypens inverkan på resultaten hos patienter med primär icke-muskulärt invasiv blåscancer. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Risk för bukspottkörtelcancer och ABO-blodgruppsalleler: resultat från pankreascancerkohortkonsortiet. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. Genen som kodar för blodgruppsantigenet I: översyn av ett I för ett öga. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. Uttryck av blodgruppsantigenerna A, B och H i cancervävnad korrelerar med en dålig prognos för patienter med kolorektalcancer. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO-blodgrupp och förekomst av epitelial ovariecancer. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Prognostiska variabler hos patienter med prostatacancer: inflytande av blodgrupp ABO (H), Rhesus-systemet, ålder, differentiering, tumörstadium och metastaser. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associations between ABO blood groups and biochemical recurrence after radical prostatectomy. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO-blodgruppsalleler och risk för prostatacancer: resultat från konsortiet för bröst- och prostatacancerkohort (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) ökar frekvensen av nervsparande och minskar positiva kirurgiska marginaler vid öppen och robotassisterad laparoskopisk radikal prostatektomi: erfarenhet efter 11 069 konsekutiva patienter. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Guidelines on Prostate Cancer 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blodgrupp bestämmer incidensen för bukspottkörtelcancer i Tyskland. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO-blodgrupper och cancer. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. ABO- och Lewis blodgruppssystem. Immunokemi, genetik och relation till sjukdomar hos människor. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM19690501012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Detection of blood group antigens in frozen sections of prostatic epithelium. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Uttryck av ABH/Lewis-relaterade antigener som prognostiska faktorer hos patienter med bröstcancer. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. Blodgrupp ABO-genens transkript nedregleras i humana blåsetumörer och tillväxtstimulerade urotelcellinjer. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Comparative studies of prostate cancer in Japan versus the United States. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Modellbaserade mönster i dödligheten i prostatacancer världen över. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. ABO- och Rh(D)-fenotypfrekvenser hos olika ras-/etniska grupper i USA. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Genotypisk och fenotypisk karakterisering av histobloodgruppen ABO(H) i primära blåsetumörer. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Prostatacancer: blodgrupp icke-O är en riskfaktor för VTE efter radikal prostatektomi. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Serumantikroppar mot blodgrupp A förutsäger överlevnad på PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar
.