| Ed Davis, Ph.D. |
Inledning
Lentivirus och Adeno-associerat virus (AAV) har visat sig vara ovärderliga för att föra in genetiskt material i däggdjursceller, antingen i kultur eller hela djur. Båda systemen är mycket lämpliga för många tillämpningar inom grundforskningen, t.ex. överexpression av proteiner, produktion av antikroppar och knockout av gener, och båda är lovande för genterapi. Varje virussystem har dock sina egna unika för- och nackdelar, beroende på användningsområde. GeneCopoeia erbjuder omfattande produktlinjer för både lentivirus och AAV, vilket ger dig kraftfulla och flexibla alternativ för att leverera DNA till celler. I denna tekniska anmärkning beskriver vi teknikerna bakom GeneCopoeias produktlinjer Lentifect™ lentivirus och AAVPrime™ AAV och diskuterar fördelarna med varje teknik för olika tillämpningar för att hjälpa dig att välja vilket system som bäst passar dina behov.
Varför använda virus för DNA-leverans?
Ett av de vanligaste sätten att leverera DNA till celler är genom plasmidbaserad transfektion, där cellerna behandlas med kemiska föreningar som kalciumfosfat, eller med lipidbaserade reagenser. Plasmidtransfektion är dock inte alltid önskvärd eller praktisk. Vissa celler är till exempel mycket svåra eller omöjliga att transfektera, medan de flesta odlade celler stöder infektion (även kallad transduktion) med antingen lentivirus eller AAV. För det andra kan plasmidtransfektion inte användas för DNA-överföring in vivo, vilket viral transduktion däremot kan göra. Både lentivirus och AAV kan användas för en mängd olika tillämpningar, t.ex. proteinuttryck från öppna läsramar (ORF), nedsättning av gener genom RNA-interferens (RNAi) med hjälp av kort hårnåls-RNA (shRNA), luciferas- och andra reportergen-analyser samt nedsättning av gener med hjälp av CRISPR-Cas9-systemet (clustered, regularly-interspaced, short palindromic repeats-Cas9). Många av dessa tillämpningar för virala vektorer har framgångsrikt utförts i odlade odlade odlingsfria däggdjurscellinjer, primära cellkulturer, djurmodeller och i genterapi på mänskliga patienter.
Uttrycket ”lentivirus” hänvisar till klassen av retrovirus som innefattar humant immunbristvirus (hiv), och i själva verket härstammar de flesta lentivirala system som för närvarande används från hiv (granskat i Mátrai, et al, 2010; Sakuma, et al., 2012). Lentivirus som bär transgener integreras i arvsmassan vid infektion och möjliggör därmed ett stabilt uttryck i både delande och icke-delande celler.
Lentivirala system har modifierats kraftigt från hiv under flera generationer för att göra dem säkra att hantera och användbara för tillämpningar. GeneCopoeia använder den tredje generationens lentivirala system (Dull, et al. 1998), som kräver fyra separata plasmider för att producera infektiösa viruspartiklar (virioner). En lentiviral plasmid från GeneCopoeia innehåller endast den gen av intresse (GOI) som skall uttryckas, en antibiotikavalsgen och signalsekvenserna för paketering. Ibland innehåller klonen också en fluorescerande reportergen. Den plasmid som innehåller GOI, med den selekterbara markören och reportergenen, kan rymma inserter på upp till 5-6 kb. (Figur 1), även om virala titrar sjunker dramatiskt när insatserna är större än cirka 4 kb.
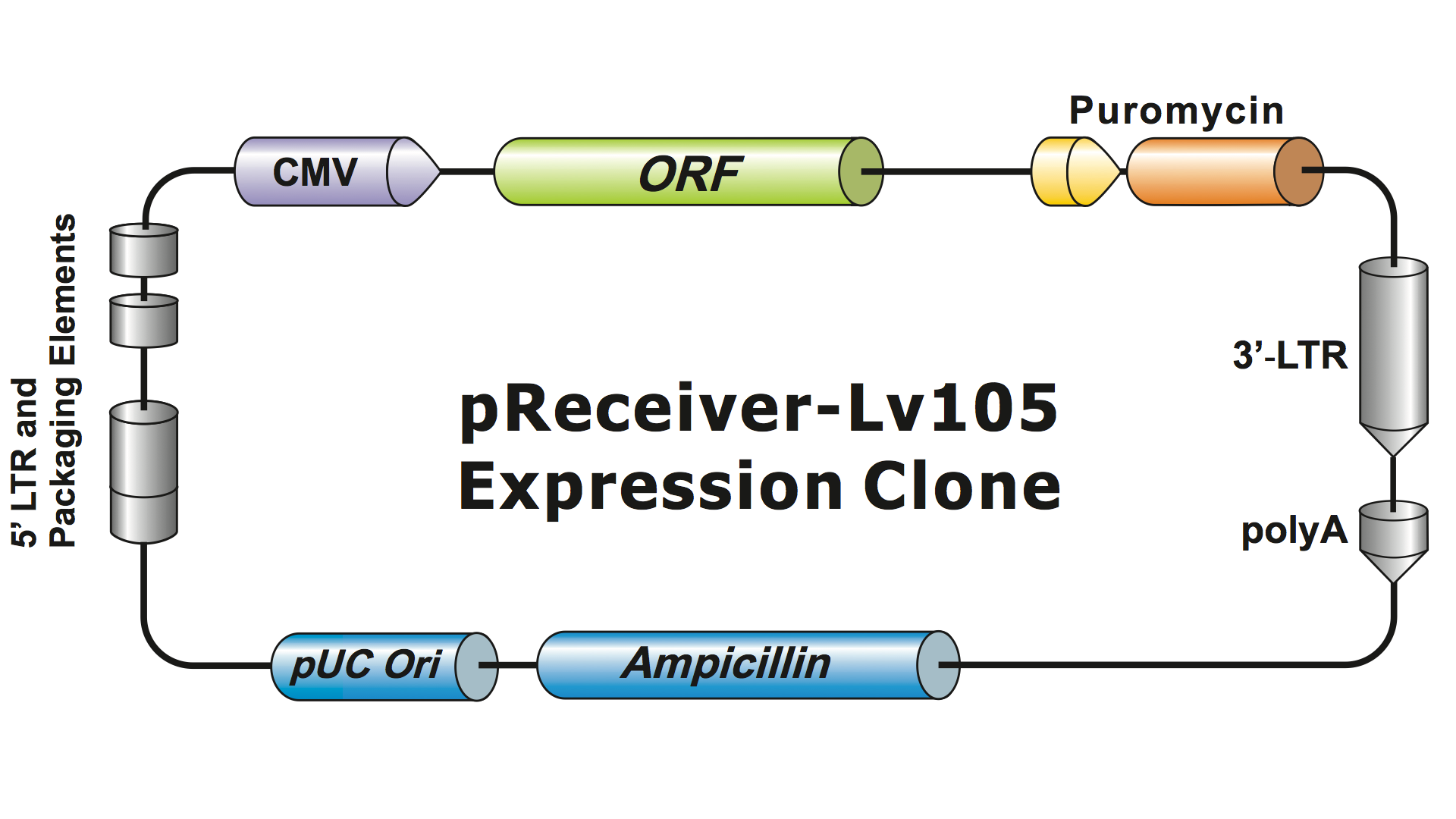 |
Figur 1. Exempel på en lentiviral uttrycksklon från GeneCopoeia |
De ytterligare plasmiderna uttrycker de retrovirala element som behövs för paketering och integration (gag, pol, env, Rev). När alla fyra plasmiderna uttrycks i förpackningsceller integreras GOI-RNA i partiklar. Eftersom de retrovirala proteinerna endast uttrycks under paketeringen kan infekterade celler inte producera infektiöst virus. Dessutom innehåller GeneCopoeias Lentifect™ lentivirala partiklar en deletion i LTR:s U3-region, vilket gör dem självinaktiverande (SIN). SIN-deletionen förhindrar lentiviral replikation i den sällsynta händelsen att alla fyra plasmiderna rekombineras för att skapa en enda aktiv virusplasmid. Därför är lentivirala partiklar säkra att hantera, med praktiskt taget ingen chans att generera patogent virus.
Förutom de förbättrade säkerhetsmodifieringarna bär GeneCopoeias lentivirala partiklar Lentifect™ vesikulärt stomatitvirus G-glykoproteinet (VSV-G) i stället för den vilda hiv env-genen, vilket ändrar virusets vävnadstropism från CD4+ T-celler till i stort sett vilken däggdjurscellstyp som helst. Lentivirus är därför ett allmänt använt system för däggdjurscellkultur, djurmodeller och genterapi.
Eftersom lentivirala vektorer har modifierats på dessa sätt har GeneCopoeias lentivirala system Lentifect™ förbättrad säkerhet och har följande egenskaper som gör dem mycket användbara för DNA-leverans:
- De infekterar nästan alla däggdjurscelltyper
- De kan användas för att leverera relativt stora DNA-sekvenser – upp till cirka 5-6 kb i längd
- De kan användas för att generera stabila cellinjer eller driva stabilt genuttryck i organ och vävnader in vivo, på grund av integration av transgenen på slumpmässiga platser i genomet
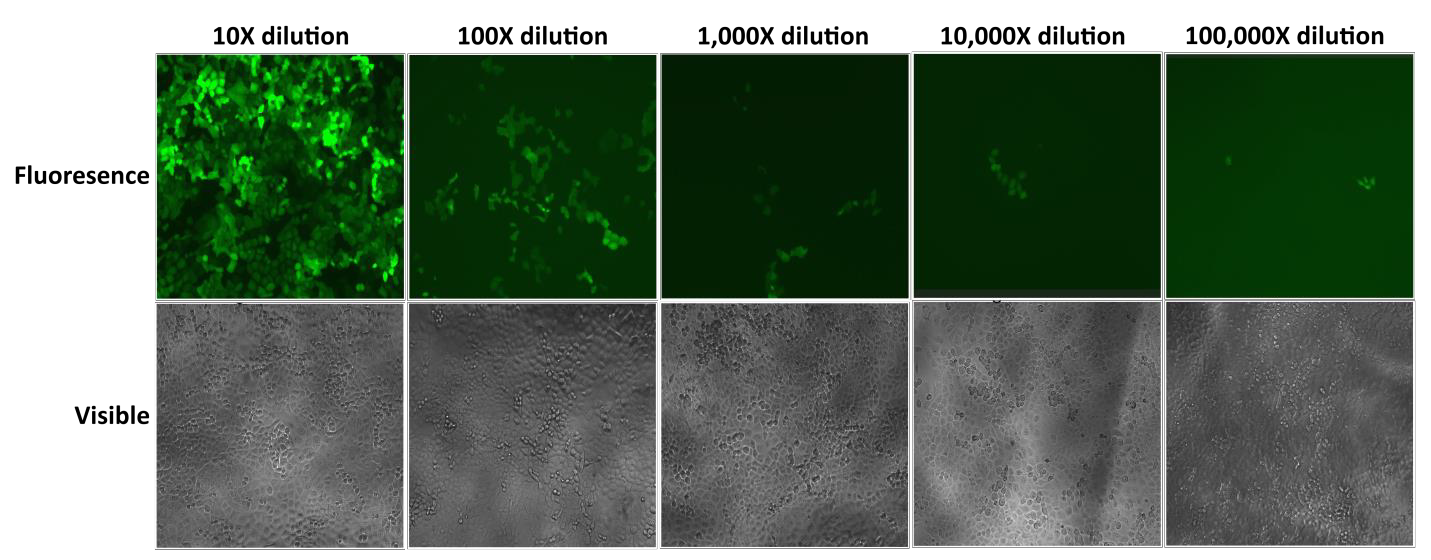
GeneCopoeias lentivirala partiklar Lentifect™ ger höga titrar, vilket gör det möjligt för forskare att effektivt uttrycka gener av intresse (figur 2).
|
Figur 2. Test av seriella spädningar av Lentifect™ lentivirala partiklar. eGFP-fluorescens fotograferades med ett fluorescensmikroskop 72 timmar efter transduktionen. |
|
GeneCopoeia erbjuder ett av branschens mest omfattande sortiment av lentivirala produkter (tabell 1).
| Produkt/tjänst | Beskrivning |
| Lentivirala kloner och kloningsvektorer | Förberedda och skräddarsydda kloner som bär på ORF:er, promotorer, shRNA:er, miRNA:s 3′ UTR:er, prekursorer och hämmare, sgRNA:er med mera. Finns med flera promotorer, taggar och rapportörer. Vektorer för gör-det-själv-kloning av sekvenser av intresse. |
| Lentifect™ lentivirala partiklar | Förtillverkade och specialförpackade, färdiga lentivirala partiklar. Producerade från GeneCopoeias omfattande, genombredda klonsamlingar eller från kloner som kunden skickat in. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Komplett system av reagenser för gör-det-själv-tillverkning av lentivirala partiklar. Inkluderar paketeringsplasmider, paketeringscelllinje, lösning för partikelkoncentration och titreringskit. |
Tabell 1. GeneCopoeias sortiment av lentivirala produkter och tjänster.
AAV-baserade system
I motsats till lentivirusens RNA-genom har AAV ett enkelsträngat DNA-genom (Samulski och Muzyczka, 2014). AAV härstammar inte heller från en patogen, utan är snarare en kontaminant av adenovirus, utan att några patogena förhållanden tillskrivs den. Naturligt förekommande AAV integreras i genomet som lentivirus, men endast vid lokus AAVS1 på kromosom 19. Denna plats är också känd som ”Safe Harbor”, eftersom den ofta används för att infoga transgener utan att skada cellerna (DeKelver, et al., 2010).
Likt lentivirus har AAV modifierats för säkerhet och användbarhet. AAV kräver saminfektion med ett hjälpvirus. AAV-genomet är 4,7 kb långt och innehåller 2 gener, Rep och Cap, som krävs för viral replikation och integration. I AAVPrime™ är Rep och Cap borttagna, så att endast de 145 bp långa 5′ och 3′ inverterade terminalrepeaten (ITR) återstår. Att stryka Rep och Cap tjänar tre syften: 1) Det eliminerar hjälparvirusets förmåga att låta AAV-infekterade celler producera nya AAV-virioner. 2) Det gör det möjligt att infoga gener som är upp till cirka 4 kb långa (även om virustitern minskar med transgener som är längre än 3 kb). 3) Det eliminerar praktiskt taget AAV:s förmåga att integrera. AAV:s ringa storlek utgör en utmaning för vissa tillämpningar. För CRISPR-genomredigering använder forskarna till exempel Cas9-nukleas från S. aureus, eftersom det är cirka 30 % kortare än det mer vanligt förekommande Cas9 från S. pyogenes (Ran, et al, 2015).
För paketering har Rep och Cap flyttats till en annan plasmid, och Adenovirus hjälpgener har placerats på en tredje plasmid, vilket gör hela paketeringssystemet säkert och fritt från hjälpvirus (figur 3).
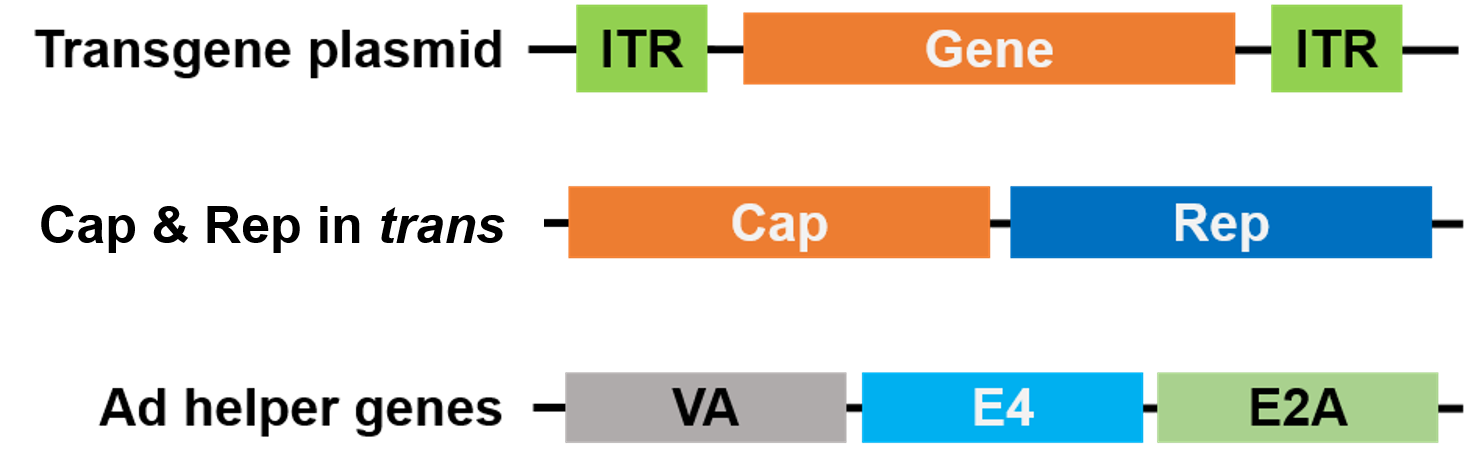 |
Figur 3. Hjälparvirusfri AAV. Tre plasmider används för paketering. Plasmidet för genen av intresse (överst) innehåller de inverterade terminalrepeaten (ITR). En andra plasmid (mitten) bär AAV:s Cap- och Rep-gener och den tredje plasmiden (botten) bär de nödvändiga generna från Adenovirus (Ad) |
Fortfarande finns AAV i olika serotyper, vilket påverkar vävnadsspecificiteten för AAV-infektion. Flera serotyper gör det möjligt för forskare att antingen a) infektera ett brett spektrum av värdceller eller b) begränsa infektionen till en eller ett fåtal vävnader. GeneCopoeias AAVPrime™ AAV-partiklar finns i flera serotyper (tabell 2).
| Serotyp | Primär målvävnad | Beskrivning |
| AAV-1 | Muskulatur | Bäst för hjärtmuskulatur, skelettmuskulatur, neuronal- och gliavävnad. |
| AAV-2 | Muskel, lever, näthinna | Den mest använda serotypen. Bäst för neuroner, muskler, lever och hjärna. |
| AAV-3 | Megakaryocyter | Bäst för megakaryocyter, muskler, lever, lungor och näthinna. |
| AAV-4 | Retina | Bäst för neuroner, muskler, hjärna och näthinna. |
| AAV-5 | Lung | Bäst för lungor, neuroner, synovialled, näthinna och bukspottkörtel. |
| AAV-6 | Muskel, Lung | Bäst för lungor, lever och hjärta. |
| AAV-7 | Muskel, näthinna, nervceller | Bäst för muskler, nervceller och lever. |
| AAV-8 | Lever | Bäst för muskler, hjärna, lever och näthinna. |
| AAV-9 | Various | Bäst för muskler, hjärta, lever, lungor och hjärna. |
| AAV-10 | Pleura, CNS | Klonat från Cynomolgus, nästan identiskt med AAVrh10 förutom 12 aminosyror i VP1. Bäst för lunga, muskel, hjärta, NCS och lever. |
| AAV-DJ | Various | En blandning av 8 naturligt förekommande serotyper. Transducerar effektivt en mängd olika celltyper in vitro. |
| AAV-DJ/8 | Various | En variant av AAV-DJ med en heparinbindande domän (HBD-mutation), vilket möjliggör infektion av lever samt andra vävnader in vivo. |
Tabell 2. Förteckning över allmänt använda AAV-serotyper
AAVPrime™ AAV-partiklar har följande egenskaper som gör dem mycket användbara för DNA-leverans:
- Höga titrar. Titer av renade partiklar kan vara upp till 10^14 GC/ml (genomkopior/ml)
- Mångsidig. Flera serotyper möjliggör användning i antingen ett brett eller begränsat antal värdceller
- Låg toxicitet. Integreras inte i värdgenomet.
- Låg immunogenicitet. Minimalt immunförsvar hos värden.
- Säker. Inte förknippad med någon mänsklig sjukdom
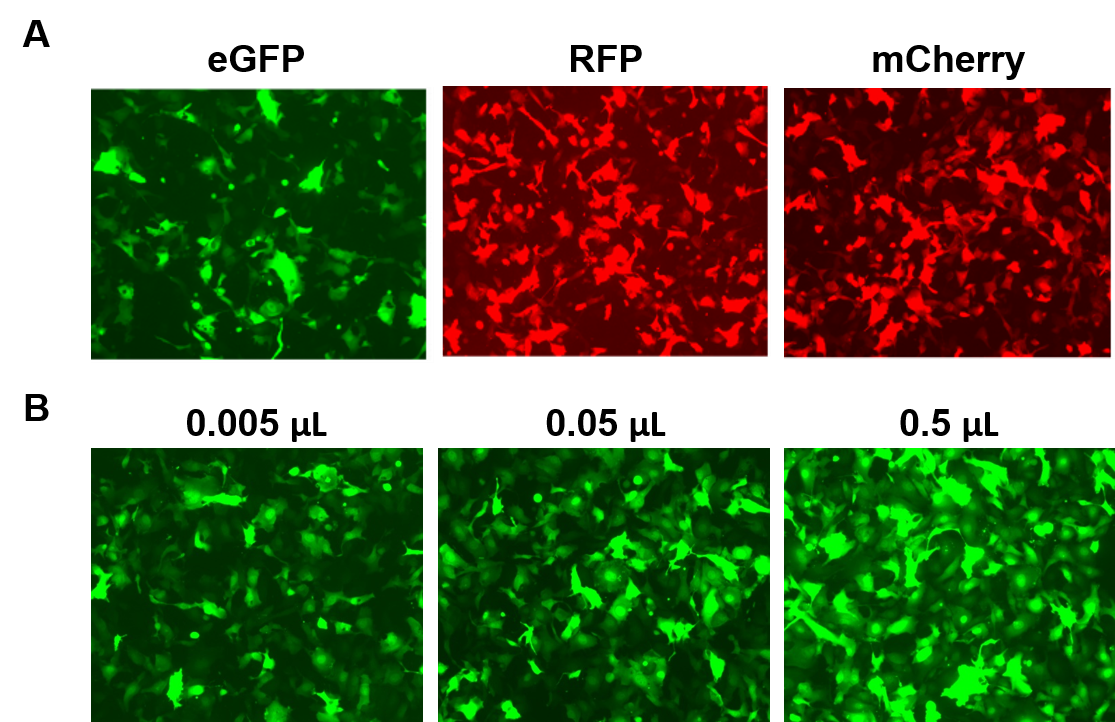
AAVPrime™-partiklar finns tillgängliga för ORF:er från människa och mus på upp till 3 kb, i flera serotyper och promotoralternativ, i antingen standardrenhet (endast för in vitro-användning) eller renad (för in vivo-användning). Kunderna kan beställa plasmidkloner, skräddarsydda partiklar för gener av intresse eller välja bland färdiga alternativ som uttrycker gener såsom fluorescerande rapportörer (figur 4).
|
Figur 4. Prestanda hos GeneCopoeias AAVPrime™-partiklar. A. HT1080-celler i 24-hålsplattor transducerade med 0,5 µl AAV av standardrenhet som uttrycker förstärkt GFP (eGFP), rött fluorescerande protein (RFP) och monomert körsbär (mCherry). B. HT1080-celler i 24-hålsplattor transducerades med varierande mängder renad AAV som uttrycker eGFP. Cellerna visualiserades med ett fluorescensmikroskop (Exponeringstid: 400 ms). |
|
Vad ska jag välja: Lentivirus eller AAV?
Att välja mellan lentivirus och AAV beror på många faktorer. Det faktum att lentivirus integrerar i genomet kan till exempel vara både en fördel och en nackdel, beroende på vilka behov man har. Se tabellen nedan för att hjälpa dig att fatta ett beslut:
| Större inserter | Stabil integration | Nej. integration | Cell-/vävnadsspecificitet | in vivo säkerhet | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
För att få veta mer om GeneCopoeias virussystem och för att beställa, besök vår webbplats (https://www.genecopoeia.com/product/lentiviral-system/)
Slutsatser
Vi på GeneCopoeia strävar efter att förse dig med produkter av högsta kvalitet och spjutspetsteknik för funktionell genomik och cellbiologi. Vi erbjuder ett brett spektrum av produkter från genomomfattande uppsättningar av plasmid-DNA-kloner för ORF:er, genpromotorer, miRNA:er, shRNA och CRISPR, till kraftfulla kit och reagens, till produkter för fluorescerande cellstrukturprober, nukleinsyrakvantifiering och märkta antikroppar. Om du vill veta mer kan du besöka vår webbplats, www.genecopoeia.com, eller kontakta oss på [email protected].
DeKelver, et al. (2010). Funktionell genomik, proteomik och regulatorisk DNA-analys i isogena miljöer med hjälp av zinkfingernukleas-driven transgenes till ett safe harbor locus i det mänskliga genomet. Genome Res 20, 1133.
Dull, et al. (1998). En tredje generationens lentivirusvektor med ett villkorligt paketeringssystem. J. Virol. 72, 8463.
Ran, et al. (2015). Genombredigering in vivo med hjälp av Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Lentivirala vektorer: grundläggande till translationella. Biochem. J. 443, 603.
Samulski och Muzyczka (2014). AAV-medierad genterapi för forskning och terapeutiska ändamål. Annu. Rev. Virol. 1, 427.